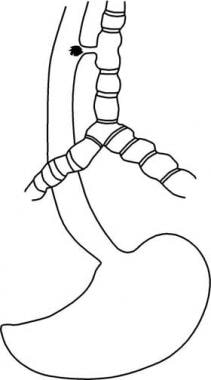
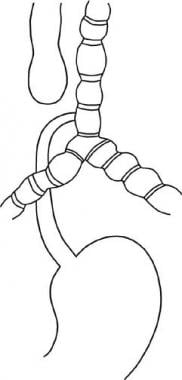
Una fístula traqueoesofágica (TEF) es una comunicación congénita o adquirida entre la tráquea y el esófago. FET a menudo conducen a complicaciones pulmonares graves y mortales.
Ver las imágenes a continuación.
La siguiente tabla describe las 5 categorías principales de los FET congénitas.
Mesa. Clasificación de las fístulas congénitas traqueoesofágica y atresia esofágica(abierto mesa en una ventana nueva)
| Las características anatómicas | Porcentaje de casos |
| atresia esofágica con FTE distal | 87 |
| atresia esofágica aislada sin TEF | 8 |
| aislado TEF | 4 |
| atresia esofágica con TEF proximal | 1 |
| La atresia esofágica con extremos proximal y distal TEF | 1 |
La mayoría de los pacientes con FET son diagnosticados inmediatamente después del nacimiento o durante la infancia. FET se asocian a menudo con complicaciones que amenazan la vida, por lo que generalmente se diagnostican en el período neonatal. En casos raros, los pacientes con un TEF congénita pueden presentar en la edad adulta.
Adquiridos FET ser secundaria a la enfermedad maligna, infección, rotura de divertículos, y trauma. FET postintubación poco común se producen después de la ventilación mecánica prolongada con un tubo endotraqueal o traqueotomía.
perspectivas históricas
El crédito para la primera descripción de FET va a Thomas Gibson, quien, en 1697, informó de un caso de un lactante con atresia esofágica y un TEF. En 1839, Thomas Hill contó de nuevo los síntomas de otro bebé con un TEF y un ano imperforado asociado. En 1888, Charles Aceros, un cirujano de Londres, se convirtió en el primer cirujano para operar en la atresia de esófago. En el siglo 19, el trabajo innovador por muchos cirujanos en última instancia condujo a la exitosa reparación primaria de Cameron Haight en 1941. pionero de las técnicas quirúrgicas en las últimas décadas se ha producido tasas de supervivencia de casi el 100% de los recién nacidos con esta anomalía congénita vez sin esperanza.
fisiopatología
Aproximadamente el 17-70% de los niños con FET han asociado anomalías del desarrollo. Estas anomalías incluyen el síndrome de Down, la atresia duodenal y defectos cardiovasculares. Las siguientes anomalías congénitas se han reportado con frecuencia variable:
- anomalías cardíacas incluyen defecto septal ventricular, ductus arterioso permeable, tetralogía de Fallot, defectos del tabique auricular, y el arco aórtico derecho.
- anomalías urogenitales incluyen agenesia renal o disfagia, riñón en herradura, riñón poliquístico, ureterales y uretrales malformaciones e hipospadias.
- anomalías gastrointestinales incluyen ano imperforado, atresia duodenal, mala rotación, malformación intestinal, divertículo de Meckel, y páncreas anular.
- anomalías musculoesqueléticas incluyen hemivértebras, disfagia radiales o Amelia, polidactilia, sindactilia, malformación torácica, escoliosis, y la más baja de defectos de las extremidades.
Embriología
El conocimiento de la embriología es esencial para entender la patogénesis de la FET congénitas.
El esófago y la tráquea tanto se desarrollan a partir del intestino primitivo. En un embrión de 4 a 6 semanas de edad, la parte caudal del intestino anterior forma un divertículo ventral que evoluciona en la tráquea. El pliegue longitudinal traqueoesofágica fusiona para formar un tabique que divide el intestino anterior en un tubo laringotraqueal ventral y un esófago dorsal. La desviación posterior del tabique traqueoesofágica provoca la separación incompleta del esófago del tubo laringotraqueal y resulta en un TEF.
formación incompleta del esófago se conoce como atresia de esófago, que puede estar asociado con FET. Muchas variaciones anatómicas de la atresia esofágica con o sin un TEF puede ocurrir. La anomalía más común consiste en una bolsa esofágica ciega y un TEF distal. atresia esofágica puro sin un TEF es la segunda forma más común. La tercera anomalía más común es la fístula de tipo H, que consiste en un TEF sin atresia de esófago.
FET no malignas adquiridos
FET traumáticas se producen ya sea secundaria a un traumatismo cerrado o avulsión abierta en el cuello y el tórax. En lesiones traumáticas romos, la TEF es intratorácica y por lo general se encuentra en el nivel de la carina. El TEF aparece varios días más tarde como resultado de la necrosis de la pared traqueal. FET causadas por la intubación tubo endotraqueal dependen de varios factores, incluyendo la intubación prolongada, un tubo irritante o abrasivos, y la presión ejercida por el manguito. Las presiones superiores a 30 mm Hg pueden reducir significativamente la circulación capilar de la mucosa y dar lugar a la necrosis traqueal. La presión del manguito es particularmente arriesgada cuando ejercida posteriormente contra un tubo nasogástrico rígido en el esófago. La mala nutrición, infección, y la alteración del tejido uso de esteroides causa, lo que predispone a los pacientes con el desarrollo de la FET.
FET ocurren con poca frecuencia en el momento de la traqueotomía o secundaria a la colocación incorrecta del tubo traqueal debido a la incisión traqueal inadecuada. El tubo de traqueotomía en mala posición ejerce presión contra la parte posterior del esófago, lo que resulta en daño a los tejidos y TEF.
FET malignas adquiridos
Esta complicación devastadora da lugar a la contaminación de las vías respiratorias, lo que lleva a las infecciones pulmonares y muerte por sepsis dentro de unas pocas semanas de desarrollo. Aunque el sitio del tumor más común es el esófago, tumores en otros sitios, incluyendo los pulmones, la tráquea, y los ganglios linfáticos metastásicos en la laringe, también puede resultar en FET. El sitio anatómico de un TEF es la tráquea en más de 50% de los casos;aproximadamente 40% se presentan en la bronquios principales izquierdo y derecho, y un número menor (6%) se producen en el parénquima pulmonar. A pesar de un tratamiento agresivo, el pronóstico es generalmente pobre en esto
Epidemiología
Frecuencia
Estados Unidos
FET son una anomalía congénita frecuente, con una incidencia de 1 caso en el 2000-4000 nacidos vivos. FET adquiridos son muy raras y las tasas de incidencia no han sido bien documentados.
FET no malignas adquiridos ocurren en aproximadamente el 0,5% de los pacientes sometidos a traqueotomía. [1] La incidencia de FET malignos se informó en el 4,5% para los tumores esofágicos malignos primarios, y del 0,3% para los tumores pulmonares malignos primarios. [2] Otros investigadores han informado de la incidencia de FET secundaria a carcinoma esofágico para ser 4/3 a 8/1%.
Morbilidad mortalidad
Consulte la siguiente lista:
- El manejo quirúrgico y perioperatorio de FET congénitas han mejorado significativamente. Las tasas de supervivencia de 100% se puede lograr en los niños que no tienen graves anomalías congénitas asociadas.
- Los pacientes pueden desarrollar morbilidades después de la reparación TEF, incluyendo traqueomalacia, alteración de la motilidad esofágica, reflujo gastroesofágico y disfagia. Además, los pacientes pueden desarrollar problemas pulmonares de aspiración recurrente.
- Los pacientes con FET adquiridas tienen altas tasas de mortalidad y morbilidad a causa de enfermedades críticas y comorbilidades.
Carrera
Sin predilección racial es evidente.
Años
Consulte la siguiente lista:
- FET congénitas se observan principalmente en los recién nacidos y durante el primer año de vida.
- Los adultos rara vez se presentan con FET congénitas que no había sido diagnosticado durante sus primeros años de vida.
- FET adquiridos pueden ocurrir en individuos de cualquier edad, y personas de edad avanzada tienen un mayor riesgo si se vuelven dependientes del ventilador debido a insuficiencia respiratoria.
Historia
Consulte la siguiente lista:- La atresia esofágica en el feto debe ser considerado como una causa de polihidramnios materno. Ausencia de gases en el estómago durante la ecografía prenatal es otra indicación de la atresia esofágica.
- Los recién nacidos con atresia esofágica generalmente se desarrollan copiosas finas burbujas de la espuma, blanco de moco en la boca y la nariz.Secreciones recurren a pesar aspiración.
- Los bebés pueden desarrollar la respiración traqueteo y los episodios de tos y ahogo en asociación con cianosis.
- Los síntomas empeoran durante la alimentación en presencia de un TEF.
- Los síntomas inducidos por FET malignos son tos, aspiración, y fiebre. La duración media de los síntomas hasta el diagnóstico es de aproximadamente 12 días.
Físico
Consulte la siguiente lista:- Realizar un examen físico cuidadoso para documentar / excluir otras anomalías del desarrollo asociados.
- En presencia de un TEF, distensión abdominal puede ser secundaria a la acumulación de aire en el estómago.
causas
Aunque no existe una causa definida para el FET congénitas, se ha reportado una asociación con trisomías 18, 21 y 13. Además, el uso de descongestionantes que contienen derivados de imidazolina por las mujeres durante el primer trimestre del embarazo se ha relacionado con un mayor riesgo de FET congénitas. [3]Las causas de la FET adquiridos incluyen lesión iatrogénica, contundente en el pecho o trauma en el cuello, a través de la ventilación mecánica prolongada endotraqueal o tubo de traqueotomía, y la presión excesiva del manguito del tubo en pacientes ventilados para la enfermedad pulmonar.Spigel et al investigaron el desarrollo de los FET en pacientes con de células pequeñas y el cáncer de pulmón de células no pequeñas. Ellos reportaron sus hallazgos a partir de 2 fase II de ensayos clínicos pequeños e independientes en los que los pacientes se les administró bevacizumab en combinación con quimioterapia y radiación. [4] Ambos ensayos se cerraron temprano por razones de seguridad. Sin embargo, los datos sugieren una asociación entre el uso de bevacizumab y quimiorradioterapia y una incidencia relativamente alta de los FET en la configuración de células pequeñas y el cáncer de pulmón de células no pequeñas. [4]Consideraciones de diagnóstico
pseudodivertículo faríngea debe considerarse en el diagnóstico diferencial de los FET. Esto puede ser secundaria a perforación traumática de la faringe posterior de la inserción de un dedo en la orofaringe durante el parto o después de grandes esfuerzos en la inserción del tubo durante la reanimación del recién nacido. Estos pacientes desarrollan neumomediastino.Una causa muy rara de dificultad respiratoria neonatal es agenesia traqueal, que siempre es fatal en cuestión de horas después del nacimiento. En agenesia traqueal, un tubo nasogástrico se puede insertar fácilmente.Zenker divertículo se conoce también como bolsa de la hipofaringe posterior y divertículo faringoesofágica. Esta condición implica la hernia de la mucosa y submucosa a través de las fibras oblicuas y transversales del músculo cricofaríngeo. La bolsa ciega desarrolla en la unión faringoesofágica a nivel del espacio discal C5-C6. La bolsa es el resultado de hiperdinámica contracción del esfínter cricofaríngeo asociada con una anormalidad de relajación cricofaríngeo.Los diagnósticos diferenciales
- divertículo de Zenker
Estudios de imagen
Consulte la siguiente lista:- El diagnóstico prenatal de FET congénitas: La ecografía prenatal puede revelar polihidramnios, ausencia de estómago lleno de líquido, pequeño abdomen, el peso fetal por debajo de lo esperado, y una bolsa de esófago distendido.
- diagnóstico postnatal de FET congénitas
- Las radiografías simples de tórax pueden revelar la compresión traqueal y la desviación. La ausencia de una burbuja gástrica indica atresia esofágica sin TEF o atresia esofágica con un TEF proximal. La radiografía de tórax lleva al diagnóstico de TEF en la mayoría de los casos de TEF congénita, y rara vez se requieren otras investigaciones.
- La neumonía por aspiración en los segmentos posteriores de los lóbulos superiores puede ser secundaria a la aspiración de los contenidos de la bolsa de esófago o el estómago. Recurrente o aspiración masiva puede conducir a la lesión pulmonar aguda en algunos pacientes. (Infiltrados se producen de forma difusa en estos pacientes.)
- La inserción de una sonda nasogástrica puede mostrar que arrolla en el mediastino de los pacientes con atresia esofágica concomitante. Este hallazgo es diagnóstico de FET asociados con atresia esofágica.
- estudios de contraste rara vez son necesarios para confirmar el diagnóstico. Estos estudios tienen el riesgo de neumonía por aspiración y la lesión pulmonar, y añaden información mínima que el estudio diagnóstico. Si se realiza el estudio de contraste, 1-2 ml de bario se instila a través de un catéter 8F colocado en el esófago. Las radiografías de tórax se toman en la posición de decúbito lateral, así como la posición anteroposterior para detectar derrame del contraste en la tráquea.
- El uso de la tomografía computarizada multidetector han hecho en 3 dimensiones (3D) de las pantallas de muchos órganos y estructuras de una herramienta de exploración clínica popular, ya que la calidad de las imágenes ha mejorado notablemente. Presencia de TEF fue diagnosticado correctamente con esofagograma TC multidetector.Además, las imágenes proporcionadas información crucial para la planificación de la cirugía, y, sin medio de contraste, es un examen menos invasivo.
- El diagnóstico de la FET adquiridos
- FET adquiridos pueden ser diagnosticados mediante instilación de medios de contraste en el esófago o durante la visualización directa por esofagoscopia flexible o broncoscopia. Cualquiera de estos métodos puede ser útil, dependiendo de la experiencia y la experiencia del centro individual.
- Algunos médicos prefieren visualizar la fístula y evaluar su ubicación exacta antes de la cirugía. El diagnóstico de un tumor maligno secundario a TEF se confirma mediante radiografía de contraste, esofagoscopia, broncoscopia, y los ensayos clínicos (azul de metileno).
procedimientos
Consulte la siguiente lista:- esofagoscopia flexible o la broncoscopia flexible pueden ser útiles en el diagnóstico de FET adquiridos. Uno o ambos de estos procedimientos pueden ser necesarios para evaluar la anatomía de estas estructuras y para excluir una lesión de la mucosa desprevenido. El papel de los procedimientos endoscópicos es especialmente importante en la localización de la TEF no maligno o maligno adquirida
Atención médica
La reparación quirúrgica es necesaria tras la confirmación de un diagnóstico de TEF.- En los lactantes sanos sin complicaciones pulmonares, la reparación primaria se lleva a cabo dentro de los primeros días de vida. La reparación se retrasa en pacientes con bajo peso al nacer, neumonía u otras anomalías importantes. Inicialmente, el tratamiento de los pacientes de forma conservadora con nutrición parenteral, gastrostomía, y la succión bolsa superior hasta que se consideran de bajo riesgo.
- Antes de la operación, un tubo endotraqueal con manguito se coloca distal al sitio de la fístula con el fin de prevenir el reflujo del contenido gástrico en los pulmones. La ventilación mecánica tras la reconstrucción traqueal en curso está asociada con la recurrencia de la FET o reestenosis. Por tanto, un enfoque conservador se utiliza hasta que el paciente se destete del respirador mecánico. Un tubo de traqueotomía se coloca distalmente a la TEF si es posible. La cabecera de la cama es elevada, y las secreciones orales se succiona con frecuencia. Una sonda de gastrostomía se coloca para reducir al mínimo el reflujo gastroesofágico, y un tubo de alimentación de yeyunostomía se coloca con fines nutricionales. Si el ensuciamiento de las vías respiratorias sigue, pueden ser necesarios procedimientos de derivación esofágica.
- Desde FET adquiridos no se cierran de forma espontánea, la reparación quirúrgica está prevista si el paciente es lo suficientemente estable. Los pacientes críticos son manejados de forma conservadora hasta que bastante estable durante un procedimiento quirúrgico mayor.
- El tratamiento de la FET malignos debe ser individualizado, y el tratamiento debe instituirse rápidamente. La terapia es generalmente paliativo. Paliación consta de alivio de la obstrucción y la desviación de la contaminación de las vías respiratorias. Los procedimientos que se ofrecen incluyen la exclusión de esófago o de derivación, la resección, el cierre directo, o endoprótesis. La terapia de apoyo se recomienda para pacientes que se presentan tarde en el curso de la fístula y ya tienen la sepsis pulmonar. Las medidas de apoyo incluyen el drenaje nasogástrico, traqueostomía, gastrostomía, y la hidratación intravenosa y antibióticos.
- Burt informó que la terapia de derivación y la radioterapia fueron los únicos tratamientos que prolongan significativamente la supervivencia en comparación con la atención de apoyo. Con la radioterapia, FET inicialmente a curar, pero por lo general se repiten, lo que lleva a la contaminación de las vías respiratorias. de bypass gástrico esofágico con, colon, o la interposición yeyunal habría mejorado significativamente las tasas de supervivencia, pero tiene un alto riesgo de mortalidad inmediata.
Cuidado quirúrgico
FET congénitas
En la fase preoperatoria, el riesgo de aspiración debe ser reducida. la aspiración continua de la bolsa esofágica ciego con un catéter 8F puede disminuir el riesgo de la aspiración. La cabeza del bebé debe ser elevado, y él o ella debe ser hidratado y el consumo de energía proporcionada (ingesta calórica) a través de una solución de dextrosa intravenosa.Si el paciente desarrolla insuficiencia respiratoria aguda, se llevan a cabo la intubación endotraqueal y ventilación mecánica. Administrar antibióticos de amplio espectro para los pacientes que pueden haber desarrollado la infección del tracto respiratorio inferior. Para pacientes que tienen neumonía u otros problemas pulmonares, una gastrostomía para la descompresión gástrica puede ser necesaria para evitar una mayor reflujo del contenido gástrico en la tráquea. El uso de inhibidores de la bomba de protones puede ser útil.reparación quirúrgica- Tiempos de operación y elección del abordaje quirúrgico en el FET congénitas son cruciales. Tomar decisiones basadas en el tamaño y el estado del bebé. Se recomiendan mayoría de los bebés a someterse a la atención primaria; Sin embargo, se recomienda una reparación por etapas varias semanas después del nacimiento para los bebés que son prematuros y tienen el síndrome de dificultad respiratoria grave. La presencia de otras comorbilidades graves, como la neumonía por aspiración, enfermedad cardíaca congénita, u otras condiciones que amenazan la vida, también debe retrasar la reparación primaria. Se requiere traqueotomía sólo si la planificación de una reparación por etapas. Los bebés que tienen síndrome de dificultad respiratoria severa pueden requerir el uso de un catéter de globo Fogarty a anular la TEF a la espera de la cirugía.
- La reparación se lleva a cabo a través de toracotomía derecha en la posición de decúbito lateral izquierdo, y el jefe de mesa es elevada para evitar el reflujo gástrico. Una incisión de toracotomía posterolateral se hace a través del cuarto espacio intercostal, y se obtiene una exposición retropleural.Durante la disección, la vena ácigos se divide y se identifica el nervio vago. El esófago distal se identifica y se diseca distal a la TEF. La fístula se divide y el cierre se lleva a cabo con suturas. La disección se realiza con cuidado para evitar la interrupción del suministro de sangre o las ramas que salen del nervio vago. línea de sutura traqueal puede estar cubierta con un colgajo de la pleura mediastinal. Antes de la anastomosis esófago, se moviliza la bolsa proximal de la tráquea.
- Si una fístula se encuentra entre la bolsa de esófago y la tráquea, se divide y se cierra. La anastomosis esofágica se realiza en 1-2 capas y se cubre con la pleura mediastinal. Un tubo de alimentación nasogástrica se coloca a través del esófago hasta el estómago antes del cierre en el pecho, y un tubo de pecho se coloca en el espacio retropleural.
- Después de la operación, el bebé está bien ventilado, según sea necesario, se reanudan alimentación nasogástrica o gastrostomía, y un contraste golondrina examen radiográfico se lleva a cabo en el séptimo día del postoperatorio. Si no se detecta una fuga, se reanudan la alimentación oral.Aproximadamente 3 semanas más tarde, el esófago se dilata hasta un tamaño 24F con el fin de evitar en el futuro estenosis esofágica.
- Las complicaciones más comunes de la cirugía son la neumonía y atelectasia lleva a insuficiencia respiratoria en el período postoperatorio. Una fuga en el lugar de la anastomosis y el neumotórax son otras complicaciones. La mayoría de los pacientes que desarrollan una fuga anastomótica también desarrollar estenosis, que puede ser dilatado después. [5] En raras ocasiones, un TEF recurrentes pueden desarrollar. La gestión de los FET recurrentes por lo general requiere una reparación quirúrgica de repetición. Algunos pacientes desarrollan episodios de apnea periódicas que probablemente secundaria a reflujo gastroesofágico y laringoespasmo asociado.
- Atresia esofágica con fístula traqueo-esofágica es una anomalía congénita relativamente frecuente. La investigación con modelos de roedores está contribuyendo a la comprensión científica de la condición. Los avances en la atención quirúrgica y manejo neonatal han mejorado la supervivencia de aproximadamente el 90%. Largo distancia y aisladas atresia esofágica presentan retos importantes de la administración. Complicaciones postoperatorias y largo plazo, incluyendo la estenosis esofágica, reflujo gastro-esofágico, y compromiso respiratorio se mantienen relativamente común y siguen planteando un desafío para la gestión continua del paciente.[6]
- La reparación de la atresia esofágica y fístula traqueoesofágica tradicionalmente se ha realizado a través de toracotomía. Los recientes intentos de reparación toracoscópica han demostrado que dicha reparación es factible, pero técnicamente difícil. Sin embargo, se necesitan más datos para una evaluación adicional de este enfoque, particularmente en defectos de brecha larga que requieren más amplia disección y anastomosis difícil.
- Wang y sus colegas examinaron los resultados nacionales en pacientes recién nacidos con atresia esofágica y fístula traqueoesofágica (EA / TEF) En los Estados Unidos, el uso de la Base de datos para pacientes hospitalizados los niños (KID). Los investigadores analizaron las hospitalizaciones de pacientes pediátricos con EA / TEF. Se identificaron 4168 casos con un diagnóstico de EA / TEF. La mortalidad hospitalaria global fue del 9%. El análisis univariante reveló una menor supervivencia en pacientes con síndrome de dificultad respiratoria aguda asociada, defecto septal ventricular (VSD), peso al nacimiento (PN) <1.500 g, edad gestacional (GA), el tiempo de operación dentro de las 24 h del ingreso, coexistiendo anomalía renal, imperforado ano, raza afroamericana, y el estatus económico más bajo. Regresión logística multivariante identificó PN <1500 g, operación dentro de las 24 h, EG <28 semanas, y la presencia de VSD como predictores independientes de mortalidad hospitalaria. Los investigadores encontraron que los hospitales generales de los niños y las unidades de los niños en un hospital general lograron una tasa de mortalidad más baja en comparación con las instalaciones no identificados como un hospital de niños. [7]
- En un estudio diferente de 268 recién nacidos con EA / TEF, 8 (3%) eran extremadamente bajo peso al nacer (EBPN, <1.000 g) y tenía una alta morbilidad y mortalidad asociadas principalmente con complicaciones no relacionadas con EA reparación / TEF. [8]
FET no malignas adquiridos
La descompresión gástrica se consigue a través de una sonda nasogástrica. Los pacientes que no son aptos suficiente para soportar la cirugía temprana son tratados de forma conservadora con la descompresión de gastrostomía y yeyunostomía de alimentación. Si un paciente está gravemente enfermo y la cirugía reparadora no puede llevarse a cabo de manera oportuna, considere la ligadura de esófago, creación de una fístula de alto salival, y la alimentación de gastrostomía.la reparación quirúrgica y el manejo del paciente- Antes de que el procedimiento en sí, se toma una decisión clínica con respecto a si la fístula puede ser simplemente resecado y cerrada o si es necesaria una resección traqueal y reconstrucción. Una incisión collar bajo se utiliza para la reparación de la mayoría de las fístulas; sin embargo, una toracotomía lateral derecha se utiliza para fístulas alrededor de la carina. Una fístula pequeña y normal tráquea no requiere la resección traqueal. La fístula se identifica y se divide, y el defecto de esófago se cierra en capas. Durante la reparación de la fístula, el esófago y la tráquea se cierran en primer lugar.Los colgajos pediculados de músculo correa están posicionados entre la tráquea y el esófago para reforzar el cierre. Los músculos que se usan para la interposición pedículo son músculos esternohioideo o esternotiroideo. En la parte inferior del tórax, tras el cierre del esófago, el refuerzo con un colgajo compuesto de la pleura, el músculo intercostal, y el periostio torácica se realiza con frecuencia.
- Un gran defecto con el daño traqueal a menudo requiere la resección traqueal y reconstrucción. Después de la resección de la tráquea, el defecto de esófago se cierra longitudinalmente en 2 capas, la reconstrucción traqueal se lleva a cabo con cuidado, y se evita la tensión de la anastomosis. El músculo de la correa se utiliza para cubrir la línea de sutura esofágica y para separarlo de la línea de sutura traqueal con el fin de prevenir la recurrencia.
- El manejo postoperatorio está determinada por el estado de salud general del paciente. Si el paciente requiere intubación prolongada, se tiene cuidado de evitar colocar el manguito en la línea de sutura. El paciente no debe tener una sonda nasogástrica simultánea con el fin de evitar un riesgo de recurrencia.
FET malignas adquiridos
Más de 75% de los pacientes con FET secundarias a la intubación traqueal requiere la resección traqueal debido a los daños circunferencial a la tráquea. La ventilación mecánica tras la reconstrucción traqueal está contraindicada debido al riesgo excesivo de dehiscencia traqueal.En los pacientes que presentan el plazo de 2-3 días después del inicio y se encuentran en buen estado general, ofrecer bypass gástrico con la exclusión de esófago. exclusión esofágica puede ser realizada por esofagostomía cervical y gastrostomía, con cierre del esófago encima y por debajo de la fístula. Este procedimiento aún no se puede prevenir la sepsis pulmonar y la muerte de muchas personas.endoprótesis de esófago- La colocación de una endoprótesis de esófago se ha utilizado para paliar los pacientes con FET malignas. Una variedad de stents están actualmente disponibles; éstos incluyen los stents plásticos (por ejemplo, Medoc, Atkinson, Celestin) y stents metálicos autoexpandibles. Algunos autores han propuesto los stents esofágicos como la primera línea de tratamiento para las estenosis malignas asociadas con un TEF.
- La colocación de una endoprótesis puede ser complicado por la incapacidad de ver bien la endoprótesis, la ampliación de la FTE, y la contaminación continua de las vías respiratorias. Otras complicaciones asociadas con stents esofágicos incluyen la migración, la obstrucción, ulceración, necrosis de esófago, y la perforación retardada. La inserción de stents de plástico requiere la dilatación agresivo.
consultas
Los pacientes deben ser vistos por un gastroenterólogo o un neumólogo para la evaluación diagnóstica.Se requiere una consulta con un cirujano de tórax para la reparación quirúrgica definitiva.Cualquier paciente que está enfermo debe ser atendido en la unidad de cuidados intensivos de modo que el personal pueda controlar el sistema respiratorio del paciente y asegurar una nutrición adecuada.