Los eosinófilos son leucocitos multifuncionales, constituyentes normales del tracto gastrointestinal, excepto cuando están presentes en el epitelio escamoso del esófago.
Los eosinófilos homeostáticos residen principalmente en la lámina propia del intestino delgado y protegen contra los parásitos y las bacterias patógenas. Estas células son selectivas en su respuesta a los parásitos, permitiendo que algunos residan en la mucosa, regulando así el microbioma intestinal y participando en la homeostasis tisular.
Los eosinófilos también modulan la respuesta inmunológica, a través de la secreción de citocinas que pueden activar las células dendríticas e inducir el cambio de clase IgA en las células B. En su papel homeostático, los eosinófilos se distribuyen en forma uniforme y escasa dentro de la lámina propia y no forman racimos ni sufren desgranulaciones.
En el intestino delgado, los eosinófilos mantienen las concentraciones de IgA, mediante factores secretores que prolongan la supervivencia de las células plasmáticas secretoras de IgA, e inducen la producción de IgA secretora.
Esta inmunoglobulina es una defensa de primera línea importante en la mucosa, al prevenir la invasión de microorganismos patógenos cubriéndolos con una envoltura hidrófila que es repelida por el epitelio mucoso, permitiendo así la expulsión.
Tanto la eosinofilia tisular como la periférica se conoce desde hace mucho tiempo como evidencia de la invasión de parásitos, y como todo patólogo sabe, cuando los eosinófilos predominan en la mucosa gastrointestinal, es bueno tener en cuenta el principio de "ver eosinófilos, pensar en parásitos".
Su presencia excesiva no es beneficiosa, como en el asma y los trastornos gastrointestinales eosinofílicos, en los que el reclutamiento de eosinófilos es inducido por patógenos o alérgenos, provocando daño epitelial.
En el asma, los fenotipos de las diferentes enfermedades son claros, y la manifestación de la enfermedad no depende únicamente de una relación directa con el número de eosinófilos, sino también de la interacción entre la predisposición genética y el microbioma.
Esta interacción se conoce menos en los trastornos eosinofílicos del aparato gastrointestinal, con excepción de la esofagitis eosinofílica, caracterizada por la eosinofilia en la mucosa escamosa, en la cual se ha comprobado que existe una interacción similar entre la genética, el microbioma y los alérgenos (particularmente alimentarios).
Los trastornos eosinófilos primarios incluyen la esofagitis, la gastroenteritis y la colitis eosinofílicas. La afectación gastrointestinal también puede observarse en el síndrome hipereosinofìlico.
La causas secundarias de eosinofilia gastrointestinal son numerosas, incluyendo la hipersensibilidad a los alimentos, las reacciones medicamentosas, la infestación parasitaria y los tumores malignos, siendo más comunes que las enfermedades eosinofílicas primarias.
Otras enfermedades gastrointestinales también se caracterizan por un mayor número de eosinófilos, como la enfermedad por reflujo gastroesofágico y la enfermedad inflamatoria intestinal.
Clasificación de los trastornos gastrointestinales asociados a eosinófilos
Enfermedades eosinofílicas primarias.
• Esofagitis eosinofílica
• Gastroenteritis eosinofílica
• Colitis eosinofílica
• Síndrome hipereosinofílico con compromiso gastrointestinal.
Infiltración eosinofílica secundaria en enfermedad.
• Infección: p. Ej., Infección parasitaria o por Helicobacter pylori
• Hipersensibilidad a los alimentos o fármacos.
• Neoplasia
• Enfermedades del tejido conectivo.
• Vasculitis
Enfermedades gastrointestinales asociadas con aumento de eosinófilos
• Dispepsia funcional.
• Síndrome del intestino irritable sin constipación
• Espiroquetosis colónica
• Enfermedad por reflujo gastroesofágico.
• Enfermedad celíaca
• Enfermedades inflamatorias del intestino, incluida la enfermedad de Crohn y la colitis ulceros
|
Esta revisión se centra en los trastornos gastrointestinales eosinofílicos menos estudiados, como la gastroenteritis y la colitis, así como las más recientemente descritas, la eosinofilia duodenal, vinculada a la dispepsia funcional y, la colitis eosinofílica focal ligada a la espiroquetosis colónica.
Todos estos trastornos gastrointestinales eosinofílicos se caracterizan por un exceso de eosinófilos en la mucosa, submucosa o muscular del estómago, el intestino delgado o el colon; con frecuencia su causa es desconocida. También se describe brevemente el síndrome hipereosinofílico con afectación gastrointestinal.
| Gastroenteritis eosinofílica y colitis eosinofílica |
> Epidemiología
La revisión de una base de datos poblacional de EE. UU. de más de 35 millones de niños y adultos informó una prevalencia global de gastroenteritis eosinofílica de 5,1/100.000 y de colitis eosinofílica de 2,1/100.000 personas. Sin embargo, en otros estudios la prevalencia fue casi el doble. La gastroenteritis eosinofílica es algo más prevalente en niños, mientras que la colitis eosinofílica lo es más en adultos.
Estos trastornos prevalecen en la tercera y cuarta décadas de la vida. En EE. UU., se halló mayor prevalencia en los estados del norte, y en zonas urbanas y suburbanas más que en áreas rurales. También la prevalencia es ligeramente mayor en mujeres e individuos de raza blanca, y la mayoría de los pacientes con gastroenteritis eosinofílica tienen un nivel relativamente elevado de educación.
Es digno de mención que la gastroenteritis y la colitis eosinofílicas se asocian con enfermedades alérgicas, y con frecuencia, los pacientes tienen, en forma concurrente, alergia a medicamentos, rinitis, asma, sinusitis, dermatitis, alergias alimentarias, eczema o urticaria.
Se ha comprobado que existen casos de enfermedades autoinmunes del tejido conectivo en pacientes con gastroenteritis eosinofílica. Hay informes de 19 casos publicados que muestran una asociación entre ambas.
| En el 35% de esos pacientes, se halló una asociación con el lupus eritematoso sistémico, 20% con artritis reumatoidea, 15% con esclerosis sistémica y 15% con miositis inflamatoria. |
> Fisiopatología
La patogenia de la eosinofilia presente en la gastroenteritis y la colitis eosinofílicas está poco estudiada. La histopatología se caracteriza por un número excesivo de eosinófilos con signos de desgranulación.
Se sabe que en la esofagitis eosinofílica, los alérgenos alimentarios impulsan la infiltración de eosinófilos, ya que su eliminación de la dieta es una terapia efectiva; el 74% de los individuos con una dieta en la que se eliminaron 6 alimentos mostró una mejoría de los síntomas y la resolución histológica.
La asociación de alergia y atopia en la gastroenteritis eosinofílica y la colitis eosinofílica sugiere que en algunas personas también podrían ser responsables otros alérgenos, ya que la mitad de los pacientes con gastritis eosinofílica mostró positividad a las pruebas de sensibilidad cutánea de alérgenos alimentario o aero alérgenos, con aumento del recuento de eosinófilos en la sangre.
En los pacientes con gastroenteritis eosinofílica y aumento de la expresión de los genes involucrados en las vías operativas potenciales se observó un transcriptoma gástrico, incluyendo la Inmunidad tipo T-helper impulsada por las interleucinas 4, 5 y 13.
Los autores sostienen que es importante destacar que este transcriptoma tenía más del 90% de correlación con una esofagitis eosinofílica, lo que sugiere que tratamientos similares podrían ser eficaces para ambas condiciones.
Sin embargo, algunos pacientes con trastornos gastrointestinales eosinofílicos tienen un componente autoinmune compartido sin atopia, el cual podría conducir a la eosinofilia a través de diferentes vías inmunológicas, indicando la complejidad de esta enfermedad.
La disbiosis gastrointestinal también podría desempeñar un papel en la fisiopatología de estos trastornos. Las alteraciones en la microbiota intestinal han sido implicadas en la alergia, pero se desconoce si esto es una causa o una consecuencia de la enfermedad.
Es probable que la combinación de predisposición genética, disbiosis y medio ambiente (por ej., alérgenos ingeridos o inhalados) prepare el terreno para la eosinofilia en la colitis y la gastroenteritis eosinofílicas, pero se necesita más investigación para determinar la patogenia subyacente de estos trastornos complejos.
Los pacientes con gastroenteritis eosinofílica y colitis eosinofílica suelen presentarse con síntomas gastrointestinales inespecíficos, con un recuento de eosinófilos en sangre que puede ser normal.
Algunos estudios informan que la mayoría de los pacientes (80%) tiene, al menos, eosinofilia periférica leve.
La gastroenteritis y la colitis eosinofílica se asocian a menudo con síntomas esofágicos de enfermedad por reflujo, disfagia y otros síntomas vagos que incluyen dolor abdominal, náuseas, vómitos, falta de crecimiento, diarrea y pérdida de peso. También se han observado condiciones más graves: ascitis, vólvulo, intususcepción, perforación y obstrucción.
Probablemente, la presentación clínica depende del sitio y, la extensión y profundidad de la enfermedad en el tracto gastrointestinal. Los pacientes con una participación eosinofílica más extensa, más allá de la mucosa, en la muscular, pueden presentar obstrucción mientras que aquellos con afectación de la serosa podrían presentar ascitis.
Aunque la eosinofilia esofágica y la esofagitis eosinofílica diagnosticada han sido observadas en niños con gastroenteritis eosinofílica, hay solo un reporte de casos en adultos. Entre 30 niños con gastritis eosinofílica, 28 fueron sometidos a biopsias de esófago simultáneas. Doce (43%) tenían esofagitis eosinofílica concurrente (≥15 eosinófilos/campo de alta potencia). Ningún paciente tuvo concurrencia de colitis eosinofílica, aunque solo 7 (23%) fueron sometidos a biopsias de colon.
La gastroenteritis eosinofílica y la colitis eosinofílica pueden sospecharse en el estudio endoscópico, y las imágenes pueden ser útiles para juzgar el alcance de la enfermedad, pero para confirmar el diagnostico se necesita una biopsia.
Endoscopia, imágenes e histopatología.
En los pacientes con gastroenteritis eosinofílica, los hallazgos endoscópicos pueden parecer normales o bien presentar: eritema, manchas blancas, erosiones focales, ulceraciones, engrosamiento de los pliegues, pólipos, nódulos y friabilidad.
En 15 pacientes, los hallazgos endoscópicos fueron en gran medida inespecíficos: la mayoría tenía eritema, pero 2 pacientes presentaban úlceras en el antro duodenal.
En la colitis eosinofílica, la colonoscopia puede revelar parches de edema mucoso, eritema punteado, lesiones blanquecinas elevadas, mucosa granular pálida y ulceración aftosa, aunque estos hallazgos son poco frecuentes y no son confiables.
En cuanto a las imágenes, la afectación de la mucosa en la gastroenteritis eosinofílica puede ponerse en evidencia por la presencia de engrosamiento de los pliegues, pólipos y úlceras en la tomografía computarizada (TC).
En la enfermedad con afectación de la capa muscular se puede observar menor distensibilidad, estenosis y engrosamiento de los pliegues. Si la afectación es de la serosa, puede haber ascitis, engrosamiento omental y linfadenopatías.
Las imágenes de la colitis eosinofílica en los adultos y los niños solo han sido descritas en informes de casos y series pequeñas. Las características en estos pacientes son la presencia del signo “pata de araña” generado por el espesamiento difuso de la mucosa; este signo se produce cuando el contraste penetra marcadamente en los senos mucosos, en la sección longitudinal del intestino de la TC. Cuando hay participación de la mucosa se ha observado engrosamiento concéntrico del colon y la ascitis.
En la mayor serie de niños con colitis eosinofílica y hallazgos radiológicos publicados hasta la fecha, se notó un colon anormal en 6 de 7 pacientes, con engrosamiento parietal, de las austras (en forma aislada) y circunferencial.
La histología de las biopsias de la mucosa gastrointestinal es el estándar de oro para el diagnóstico de gastroenteritis eosinofílica y de colitis eosinofílica, y el criterio diagnóstico principal es el exceso de eosinofilia mucosa en ausencia de una causa conocida.
Sin embargo, el número de eosinófilos necesario para hacer un diagnóstico no está tan bien definido como en la esofagitis eosinofílica (15 eosinófilos/campo de gran aumento).
En una revisión reciente, 30 eosinófilos/campo de alta potencia fue un numero considerado razonable para hacer el diagnóstico de gastritis eosinofílica, mientras que para el diagnóstico de colitis eosinofílica se ha sugerido >50 eosinófilos/campo de alta potencia en el colon derecho, >35 eosinófilos/campo de alta potencia en el colon transverso o, 25/campo de alta potencia en el colon izquierdo. (mesa).
Para el diagnóstico, también se han propuesto recuentos más elevados, junto con otras características histológicas, pero solo son sugerencias derivadas de series de casos y hasta ahora no han sido validados en diferentes poblaciones, como es el caso de la esofagitis eosinofílica. Actualmente no existen pautas formales para el diagnóstico de la biopsia de la mucosa.
Debe tenerse en cuenta que los eosinófilos son constituyentes normales del intestino y que los números pueden variar ampliamente entre los individuos, según la región, el clima, la edad, la exposición a alérgenos alimentarios y a agentes infecciosos.
Cuando se evalúan las muestras de biopsia, estos factores deben ser considerados. Estos factores pueden generar dudas en torno al diagnóstico, lo que significa que hay casos que podrían pasar inadvertidos, a menos que los eosinófilos sean contados rutinariamente en todas las biopsias.
La gastroenteritis eosinofílica se clasificó originalmente en 1970 según el sitio de infiltración de los eosinófilos: mucosa, muscular o serosa.
Un estudio de 40 pacientes con gastroenteritis eosinofílica realizado en 1990 mostró que 23 de ellos tenían enfermedad de la mucosa, 12 tenían afectada la capa muscular, y 5 la subserosa. un posterior indicó claramente que había ocurrido un cambio de la afectación de la muscularis a la de la mucosa.
En este estudio, 52 pacientes tenían enfermedad de la mucosa, 3 tenían enfermedad de la capa muscular y 4 tenían enfermedad subserosa. Aunque este cambio podría ser un criterio de diagnóstico endoscópico, es probable que ahora los casos puedan ser diagnosticados antes que las series originales, haciendo una biopsia de la mucosa superficial en vez de la biopsia de espesor completo tradicional, con la consiguiente reducción de la progresión desde la capa muscular a la serosa, secundaria al tratamiento efectivo, en comparación con los informes anteriores.
La histopatología de la mucosa en gastroenteritis original y la colitis eosinofílica es similar y se describe como el exceso de eosinófilos en la lámina propia, con desgranulación y posible infiltración del epitelio superficial y de las criptas, con formación de abscesos superficiales y en las criptas.
El epitelio podría mostrar cambios degenerativos y regenerativos, con hiperplasia foveolar y de las criptas. A menudo, se observa un considerable exceso de eosinófilos dispuestos en láminas o grupos.
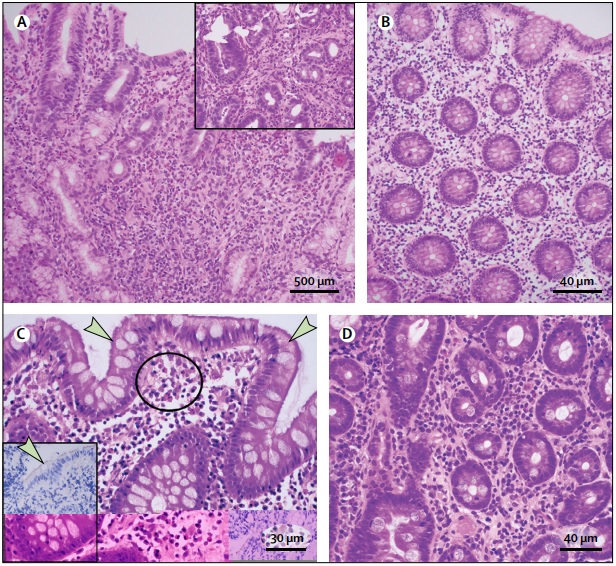
(A) Gastritis eosinofílica con láminas de> 30 eosinófilos por campo de alta potencia (HPF) en la lámina propia, agrupadas alrededor de glándulas (recuadro). (B) Colitis eosinofílica, biopsia por colon izquierdo, con> 35 eosinófilos por HPF en la lámina propia. (C) Espiroquetosis colónicas, una neblina azul en la hematoxilina y la tinción de eosina adheridas a la superficie del epitelio colónico (indicado por flechas), con grupos de eosinófilos en la lámina propia (círculo); el recuadro muestra inmunohistoquímica para identificar espiroquetas de superficie (indicado por la flecha). (D) Eosinofilia duodenal en un paciente con dispepsia funcional de tipo de angustia postprandial con 36 eosinófilos por 5 HPF en la lámina propia
La gran deposición de proteína básica mayor de gránulos de eosinófilos extracelulares, detectada por inmunohistoquímica, es indicativa de la desgranulación de eosinófilos y se ha observado con mayor frecuencia en pacientes con gastroenteritis eosinofílica que en los controles sanos.
La desgranulación puede enmascarar los recuentos de eosinófilos, como sucede en la esofagitis eosinofílica, en la que el número de eosinófilos que se halla en el epitelio escamoso fue significativamente mayor cuando se usó la inmunotinción de la proteínas básica mayor que con la hematoxilina-eosina.
> Sitios de biopsia para la gastroenteritis eosinofílica
La elección de los sitios de biopsia endoscópica intestinal es importante cuando el diagnóstico es incierto, particularmente el de la gastroenteritis eosinofílica y la colitis eosinofílica. La patología puede ser irregular, y por lo tanto, con el fin de confirmar el diagnóstico, es recomendable tomar muestras de biopsia de todas las regiones del intestino, incluyendo las lesiones macroscópicas evidentes.
Una buena práctica es basarse en el sistema de Sydney para los sitios recomendados de biopsia del cuerpo gástrico, antro e incisura; los autores recomiendan que se tomen al menos 4 muestras de biopsia de la primera y segunda porción del duodeno, tal como se aplica para el diagnóstico de la enfermedad celíaca en la enfermedad parcheada, colocado las muestras en recipientes separados.
Ante la sospecha de una gastroenteritis eosinofílico en pacientes pediátricos, también se recomienda hacer biopsias del esófago, cuerpo gástrico, mucosa antral y duodeno.
Para el diagnóstico de colitis eosinofílica no asociada a lesiones macroscópicamente visibles, se puede aplicar el mismo criterio que para la enfermedad intestinal inflamatoria, tanto de adultos como de niños, con un rendimiento óptimo cuando las muestras son tomadas de múltiples sitios, proporcionando una mayor precisión diagnóstica y mejor acuerdo diagnóstico interobservador.
Por lo tanto, en estos casos, los autores recomiendan obtener muestras de biopsias al azar del íleon terminal y de cada segmento colónico colon (desde el ciego hasta el recto), colocándolas las muestras en recipientes separados.
> Diagnósticos diferenciales
A pesar de haberse demostrado que la gastroenteritis y la colitis eosinofílicas se asocian con otras enfermedades, particularmente la alergia, se desconoce cuál es a patogénesis exacta.
Por lo tanto, estas enfermedades son diagnosticados por exclusión, ya que un número excesivo de eosinófilos en el intestino puede verse en muchas condiciones que requieren investigación clínico-patológica. Si existe eosinofilia, se debe sospechar una infección.
Las infecciones más conocidas inductoras de eosinofilia son las parasitarias. El antecedente de viajes y el examen parasitológico de las heces para detectar huevos y parásitos es una buena práctica si la biopsia muestra eosinofilia. Informes recientes de pacientes con espiroquetosis colónica asociada con el síndrome del intestino irritable sin constipación ha mostrado una eosinofilia característica en la biopsia del colon, con grupos adyacentes de espiroquetas en el epitelio colónico superficial.
Se ha comprobado que en la población general sometida a colonoscopia, el 2,3% tenía espiroquetosis colónica eosinofílica. Los recuentos fueron mayores en los pacientes con espiroquetosis del colon que en aquellos sin espiroquetosis, incluso en el recto.
Los individuos con espiroquetosis colónica son más propensos a tener síndrome inflamatorio intestinal que los que no la tienen. El 62% de los pacientes presentó diarrea, comparado con el 31% de los controles y, el dolor abdominal, en el 52%, comparado con el 17% de los controles.
La eosinofilia gástrica puede estar asociada a la infección por Helicobacter pylori, tanto antes como después del tratamiento de erradicación. La hipersensibilidad a los medicamentos también puede desencadenar eosinofilia; por ejemplo, al micofenolato y los antiinflamatorios no esteroideos. Sin embargo, debido a éstos son de uso común, siempre deben ser considerados dentro del diagnóstico diferencial.
En la hipersensibilidad a los alimentos como en la proctocolitis alérgica hay una prevalencia variada en todos los bebés sanos con una reacción adversa a la proteína de leche de vaca, que va del 0,3% al 7,5%. En un estudio prospectivo, 14 de 22 bebés (64%) con sangrado rectal tuvieron colitis alérgica (definida por el número o la ubicación de los eosinófilos), 5 (23%) tenían biopsias normales y 3 (13%), colitis inespecífica.
La hemorragia rectal en todos los lactantes con biopsias normales o colitis inespecífica se resolvió sin modificar la dieta, excepto un infante, quien posteriormente fue diagnosticado con enfermedad intestinal inflamatoria infantil.
Las biopsias de mucosa rectal en la proctocolitis alérgica se caracteriza por un aumento del número de eosinófilos en la lámina propia, el epitelio superficial y las criptas y, la muscularis mucosa, sin cambios arquitectónicos significativos.
Por lo general, este diagnóstico es clínico y los síntomas se resuelven 2 a 3 días después de la eliminación de la proteína de la leche de vaca. En las biopsias de colon de pacientes con alergia a los alimentos (una amplia gama de alimentos) se observa aumento de los eosinófilos del colon, con desgranulación.
En la enfermedad celíaca activa se ha descrito un aumento de los eosinófilos duodenales. Más recientemente, en 150 pacientes con enfermedad celíaca se ha comprobado una infiltración prominente de eosinófilos (hasta 50 eosinófilos/campo de alta potencia). Se sugirió que los eosinófilos son partícipes del daño mucoso ya que fueron hallados en los estadios histológicos más avanzados.
Las biopsias gastrointestinales en pacientes con enfermedades inflamatorias intestinales muestran eosinófilos en número variable. Cuando en las biopsias gástricas se hallan eosinófilos, se debe sospechar una enfermedad inflamatoria intestinal, ya que las biopsias de colon en pacientes con enfermedad de Crohn o colitis ulcerosa también muestran un mayor número de eosinófilos en la lámina propia, en comparación con los controles.
También se ha observado infiltración eosinófila del tracto gastrointestinal en trastornos del tejido conectivo, como la artritis reumatoidea, la esclerosis sistémica, la vasculitis y la granulomatosis eosinofílica con poliangeitis.
| Dispepsia funcional y eosinofilia duodenal |
La eosinofilia ha sido descrita en biopsias duodenales de pacientes con dispepsia funcional, particularmente en aquellos con saciedad precoz, aunque el número de eosinófilos es más bajo que el observado en la gastroenteritis eosinofílica.
En un estudio sueco, la dispepsia funcional en individuos con recuentos de eosinófilos elevados en D1 (bulbo duodenal) (>22 eosinófilos/5 campos de alta potencia) tuvo un cociente de probabilidad fue 11,7.
La eosinofilia en D1 se asoció significativamente con saciedad precoz, implicando a la eosinofilia duodenal en la aparición del distrés postprandial, un subtipo de dispepsia funcional, con 52 eosinófilos/5 campos de alta potencia en comparación con 34 eosinófilos/5 campos de alta en los controles. Se ha demostrado que la barrera intestinal alterada y el deterioro del funcionamiento neuronal acompañan a la eosinofilia duodenal en las biopsias ex vivo de pacientes con dispepsia funcional.
En biopsias ex vivo de pacientes con dispepsia funcional también se halló un aumento de la permeabilidad duodenal (medida por la resistencia eléctrica transepitelial) y paracelular, a lo largo del duodeno con eosinofilia e infiltración de mastocitos.
En estos pacientes, la señalización neuronal, medida por las respuestas del calcio a la despolarización eléctrica y química, se vio alterada en el plexo submucoso, con una significativa correlación negativa entre la respuesta de calcio a la estimulación eléctrica y el número de eosinófilos.
Es posible que estas observaciones reflejen un mecanismo orgánico del trastorno en pacientes con dispepsia funcional, por el cual un alérgeno o una infección provocan la interrupción de la barrera y la generación de una respuesta inmunológica de tipo T-helper 2, que Induce el reclutamiento y la desgranulación de los eosinófilos, lo que a su vez afecta el sistema nervioso submucoso y la función gastroduodenal. En la dispepsia funcional no se ha observado eosinofilia periférica.
| Síndrome hipereosinofílico con compromiso gastrointestinal |
Actualmente, el síndrome hipereosinofílico se define por un recuento absoluto de eosinófilos en sangre >1.500 células/μl, durante más de 1 mes (aunque si se está produciendo daño grave en el órgano terminal, el diagnóstico puede hacerse inmediatamente, para evitar retrasos terapéuticos).
También podría observarse hipereosinofilia tisular con evidencia de daño en órgano blanco mediado por eosinófilos, pero antes de hacer el diagnóstico de síndrome hipereosinofílico deben excluirse todas las causas conocidas de hipereosinofilia.
Las causas secundarias de eosinofilia en la sangre incluyen: infecciones parasitarias o virales, enfermedades alérgicas, medicamentos y productos químicos, hipoadrenalismo y, cáncer. El síndrome hipereosinofílico se caracteriza por una infiltración multiorgánica de eosinófilos en oposición a la afectación de un solo órgano como sucede en los trastornos gastrointestinales eosinofílicos.
Se ha propuesto que si los trastornos gastrointestinales eosinofílicos coexisten con hipereosinofilia sanguínea y está afectado un solo órgano, se puede usar el término síndrome de superposición hipereosinofílica. La afectación de órganos en este síndrome puede incluir el síndrome de Budd-Chiari crónico, hepatitis activa, colangitis eosinofílica, gastroenteritis eosinofílica y colitis eosinofílica, pero no esofagitis eosinofílica.
Es de destacar que el trastorno sistémico de los mastocitos, la mastocitosis sistémica, también puede manifestarse con eosinofilia intestinal, estimulada por la liberación localizada de mediadores quimiotácticos eosinófilos.
| Tratamiento de la gastroenteritis eosinofílica y colitis eosinofílica |
Las causas secundarias de la, como los medicamentos o las infecciones parasitarias, deben ser cuidadosamente evaluadas y tratadas. Si existe deficiencia de micronutrientes, también debe ser corregida. La espiroquetosis colónica, que se asocia con eosinofilia colónica y síntomas gastrointestinales, puede ser tratada con metronidazol.
Se ha demostrado que este tratamiento mejora los síntomas gastrointestinales, aunque faltan ensayos aleatorizados. También, que terapias que tienen cierta eficacia en el tratamiento de la dispepsia funcional con eosinofilia duodenal incluye a los antagonistas de los receptores de leucotrienos montelukast y a los inhibidores de la bomba de protones (posiblemente por la inhibición de la botaina).
Sin embargo, no se ha demostrado que con estas u otras terapias se produzca una mejoría de los síntomas de la dispepsia funcional como resultado de la estabilización o reducción del número de eosinófilos.
Si no se encuentra una causa secundaria de eosinofilia, se puede hacer el diagnóstico de gastroenteritis eosinofílica o colitis eosinofílica, con varias opciones terapéuticas, aunque la evidencia para la mayoría de las terapias se limita a Informes de caso y pequeñas series de casos no controlados.
Como tratamiento de primera línea para los trastornos gastrointestinales eosinofílicos se recomienda la terapia dietética.
Las dietas empíricas de eliminación de alimentos, que excluyen los antígenos alimentarios comúnmente implicados (leche, trigo, soja, huevos, frutos secos y mariscos), han demostrado su eficacia en el tratamiento de la esofagitis eosinofílica, lo que indica que la comida es un desencadenante antigénico importante en la enfermedad eosinofílica prototípica.
Varias dietas de eliminación de alimentos parecen ser eficaces en la gastroenteritis eosinofílica; sin embargo, la evidencia se limita a informes de casos y casuísticas pequeñas. En éstos, uno de los estudios más grande una serie de caso retrospectivos de 17 niños con gastroenteritis eosinofílica, mostró una tasa de respuesta clínica a esa dieta del 82%.
Aunque algunos informes de casos describen resultados exitosos de la eliminación de alimentos específicos, basados en pruebas de alergia, se ha reportado que la respuesta al tratamiento falló en las alergias alimentarias identificadas por la prueba de sensibilidad cutánea o la medición de las concentraciones séricas de IgE específicas de los alimentos, sugiriendo que la eliminación selectiva de alimentos podría no resultar eficaz.
De hecho, actualmente no se recomiendan las pruebas específicas de alergia a los alimentos para el tratamiento de la gastroenteritis eosinofílica.
El 75% de los lactantes alimentados con una dieta elemental rigurosa excluyente también mostró la eficacia de esa dieta para el tratamiento de la gastroenteritis eosinofílica y la colitis eosinofílica; sin embargo, es probable que el cumplimiento de los niños mayores y los adultos limite severamente su utilidad.
Los corticosteroides se utilizan como tratamiento farmacológico de primera línea para la gastroenteritis eosinofílica y la colitis eosinofílica, cuando la terapia dietética no logró una adecuada respuesta clínica. Se ha demostrado que 20–40 mg/día de prednisona oral, durante 2 semanas, induce la remisión clínica en la mayoría de los pacientes, aunque algunos informes recomiendan dosis más elevadas (0,5–1 mg/kg).
Los pacientes cuyos síntomas recaen durante o después de la disminución de la dosis del fármaco pueden requerir un tratamiento de mantenimiento continuado. A menudo, se utilizan corticosteroides sistémicos como la prednisona en dosis bajas (5-10 mg/día, o la dosis mínima requerida para mantener la respuesta).
Sin embargo, debido a los efectos secundarios indeseables a largo plazo de la ccorticoterapia sistémica, se pueden considerar otros agentes alternativos menos propensos a alcanzar la circulación sistémica. Se ha conseguido una buena respuesta con la utilización de budesonida (3-9 mg/día); se ha demostrado que la fluticasona oral disminuye la eosinofilia gástrica concurrente en niños con esofagitis eosinofílica.
| Agentes ahorradores de esteroides |
En los individuos que requieren terapia de mantenimiento con corticosteroides o que no responden adecuadamente a su acción, se han utilizado varios agentes, con resultados positivos. Varios de estos agentes son los que se utilizan para el tratamiento de la enfermedad inflamatoria intestinal, como la mesalazina (o ácido 5-aminosalicílico), la azatioprina y, los agentes anti-TNF, como el infliximab y el adalimumab.
Otras opciones son los estabilizadores de los mastocitos, como el cromoglicato de sodio y el ketotifeno y, el antagonista de los receptores de leucotrienos montelukast, omalizumab, un agente anti-IgE, que demostró lograr una mejoría significativa de los síntomas y una disminución del recuento de eosinófilos gastroduodenales en 9 individuos con gastroenteritis eosinofílica.
Se comprobó que el agente bloqueante de interleucina 5 mepolizumab, indujo una respuesta en un grupo de 6 pacientes con gastroenteritis eosinofílica o síndrome hipereosinofílico; sin embargo, en todos los respondedores se observó eosinofilia de rebote, con recaída clínica asociada.
Se ha comprobado que un anticuerpo nuevo dirigido contra CCR3, un receptor de eotaxina expresado por los eosinófilos, que facilita su reclutamiento a sitios de inflamación, disminuye la i9flamación eosinofílica y la diarrea en un modelo de ratón con gastroenteritis eosinofílica.
| Trasplante de microbiota fecal |
El trasplante de microbiota fecal ha demostrado ser eficaz para el tratamiento de las enfermedades inflamatorias intestinales, incluyendo la Infección por Clostridium difficile refractaria y la colitis ulcerosa.
Este tratamiento ha sido utilizado exitosamente en un paciente con enterocolitis eosinofílica con afectación del íleon y el colon, cuya enfermedad era refractaria a la nutrición enteral, la azatioprina, los esteroides y la resección quirúrgica, pero respondió al trasplante de microbiota fecal de un solo donante, además de los corticosteroides orales.
Los pacientes pueden presentar complicaciones de la inflamación intestinal incluyendo estenosis o perforación, y requieren terapia quirúrgica; pueden ser diagnosticadas incidentalmente en un muestra resecada quirúrgicamente.
Sin embargo, aún en el contexto de un abdomen agudo, una gastroenteritis eosinofílica conocida (o altamente sospechosa) o una colitis eosinofílica, los síntomas pueden responder al manejo conservador con inmunosupresores.
| Síndrome hipereosinofílico con afectación gastrointestinal |
El tratamiento para el síndrome hipereosinofílico es diferente del tratamiento de la gastroenteritis y la colitis eosinofílicas. Los corticosteroides, los agentes inhibidores de la tirosinacinasa, como imatinib, hidroxiurea, interferón-α y anti-interleucina 5,1 son efectivos para el tratamiento del síndrome hipereosinofílico. Para la infección por Strongyloides se recomienda el agente antiparasitario ivermectina.
| Curso clínico de la gastroenteritis eosinofílica y colitis eosinofílica |
El curso clínico de estas afecciones se ha descrito sobre la base de en un seguimiento de 43 pacientes, de los cuales la mayoría tuvo remisión espontánea o respondió a la terapia de primera línea. Sobre una mediana de seguimiento de 13 años, el 42% de estos pacientes no sufrió recaídas, el 37% exhibió un curso de recaídas y remisiones y, el 21% restante tenía enfermedad crónica sin remisión.
El seguimiento durante más de 1 año de los pacientes del estudio que presentaban colitis eosinofílica mostró que 5 (45%) tuvieron recaídas luego de suspender los esteroides (13 episodios); 2 de ellos requirieron tratamiento de mantenimiento a largo plazo con prednisona; 1 paciente requirió la resección ileal por perforación.
A pesar de que solo fueron 2 estudios pequeños, los datos sugieren que los pacientes que responden a la dieta inicial o a los corticosteroides deben ser monitoreados a largo plazo. En los pacientes con recaída durante la reducción o el cese de la corticoterapia, la misma puede ser aumentada o reiniciada, con vistas a su transición a un corticosteroide con menor biodisponibilidad o a un agente ahorrador de esteroides.
| Conclusiones y orientaciones futuras. |
En la actualidad, la eosinofilia en todo el tracto intestinal puede ser reconocida como un trastorno gastrointestinal eosinofílico primario (gastroenteritis eosinofílica o colitis eosinofílica), o secundario a una causa conocida como la infección parasitaria.
También han sido reconocidas nuevas enfermedades intestinales eosinofílicas, como la eosinofilia duodenal en la dispepsia funcional y la espiroquetosis del colon, con mayor número de eosinófilos colónicos.
Por lo tanto, se necesita un enfoque clínico-patológico reflexivo para asegurarse de que se realiza un diagnóstico correcto y un tratamiento dirigido. Se requieren más controles de casos y estudios de cohorte para caracterizar mejor los factores etiológicos y los antecedentes naturales de la enfermedad.
También son necesarios estudios terapéuticos rigurosos que examinen agentes ahorradores de esteroides para poder ofrecer una terapia segura y eficaz para los pacientes que requieren tratamiento de mantenimiento largo plazo.
Se espera que a medida que la investigación avance, la causa (o causas) de los trastornos gastrointestinales eosinofílicos primarios pueda ser determinada, lo que permitirá la orientación exitosa de las terapias de primera línea para estos trastornos, en lugar del enfoque de prueba y error que constituye la práctica actual.
Resumen y comentario objetivo: Dra. Marta Papponetti
