Metástasis en colon de un carcinoma ductal primario de mama
Fabián Ángel Precetti,1 Cecilia León,1 Eduardo José Marini,1 Ana Lía Ghiraldo,1 Pablo González,1Adriana Pietrantonio,2 Néstor Lucatelli2
1 Unidad de Gastroenterología.
2 Servicio de Anatomía Patológica, Hospital J M Ramos Mejía.
Ciudad Autónoma de Buenos Aires, Argentina.
2 Servicio de Anatomía Patológica, Hospital J M Ramos Mejía.
Ciudad Autónoma de Buenos Aires, Argentina.
Acta Gastroenterol Latinoam 2015;45:307-311
Recibido: 04/01/2015 / Aprobado: 07/07/2015 / Publicado en www.actagastro.org el 30/12/2015
Recibido: 04/01/2015 / Aprobado: 07/07/2015 / Publicado en www.actagastro.org el 30/12/2015
Resumen
Las metástasis en el colon del carcinoma de mama son sumamente infrecuentes. El subtipo ductal es el que más raramente afecta al tubo digestivo, en relación con el subtipo lobulillar. Presentamos un caso clínico de metástasis en colon de carcinoma ductal de mama como hallazgo en una colonoscopía de screening. De igual modo, hemos realizado una revisión bibliográfica sobre las metástasis en el tubo digestivo del cáncer primario de mama, encontrando muy pocos casos publicados en la literatura sobre este comportamiento del subtipo ductal.
Palabras claves. Metástasis, colon, carcinoma ductal invasivo de mama.
Colon metastases in primary breast ductal carcinoma
Summary
Colonic metastasis of breast cancer are extremely infrequent, being ductal subtype the most rarely affects the digestive tract, compared to lobular subtype. We present a case report of a colonic metastasis of ductal breast cancer; found in the context of a screening colonoscopy. Besides we perform an article research about digestive tract metastasis of primary breast cancer, finding very few published cases among the literature about this ductal subtype behavior.
Key words. Neoplasm metastases, colon, invasive ductal carcinoma, breast.
Abreviaturas
IHQ: inmunohistoquímica.
RE: receptores de estrógeno.
RP: receptores de progesterona.
HER2/neu: Human Epidermal Growth Factor Receptor-2/ Receptor 2 de factor de crecimiento epidérmico humano.
VCC: videocolonoscopía.
Hto: hematocrito.
CK: citokeratina.
IHQ: inmunohistoquímica.
RE: receptores de estrógeno.
RP: receptores de progesterona.
HER2/neu: Human Epidermal Growth Factor Receptor-2/ Receptor 2 de factor de crecimiento epidérmico humano.
VCC: videocolonoscopía.
Hto: hematocrito.
CK: citokeratina.
Caso clínico
Paciente de sexo femenino de 72 años de edad, que consultó a la Unidad de Gastroenterología en el 2012 para la realización de una VCC por screening de cáncer colorrectal. Como antecedentes de relevancia presentaba diabetes tipo 2, mastectomía radical derecha y vaciamiento axilar con ganglios negativos por un carcinoma ductal de mama en el año 1991 por el cual realizó tratamiento con quimio y radioterapia completos. Permaneció libre de enfermedad hasta que en el año 2009 se evidenció un nódulo palpable en la mama izquierda, realizándose la tumorectomía, con diagnóstico de carcinoma ductal invasor. IHQ: RE (-), RP (-), HER2/neu (-). La paciente no presentaba ninguna sintomatología digestiva al momento de la consulta.
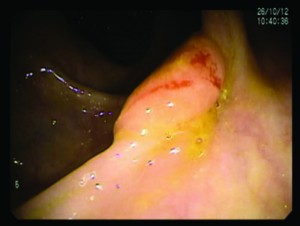
La VCC demostró en colon ascendente, cercano al ciego, un pólipo de 1 cm plano-elevado que no se pudo resecar en ese momento por inconvenientes técnicos y operativos, por lo que se biopsia (Figura 1). Se observan divertículos aislados en sigma, el resto de la mucosa es de aspecto normal. Se programó una nueva VCC para realizar la mucosectomía, pero la paciente discontinuó las consultas por motivos personales. La anatomía patológica informó un adenoma tubular con displasia de bajo grado.
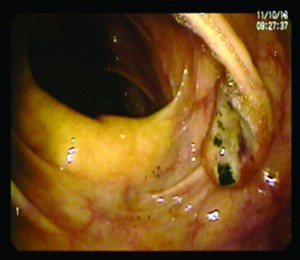
Un año después regresa a la Unidad con un cuadro de anemia ferropénica (Hto: 26%), indicándose una nueva VCC en base a los antecedentes de la paciente, donde se observa, en colon ascendente, cercano al ciego, una lesión de aproximadamente 1,5 cm de diámetro, oval, ulcerada con bordes elevados de aspecto blastomatoso, tomándose varias biopsias (Figura 2).
Figura 2. Lesión de aproximadamente 1,5 cm de diámetro, oval, ulcerada con bordes elevados de aspecto blastomatoso, cercana al ciego.
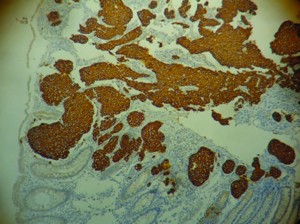
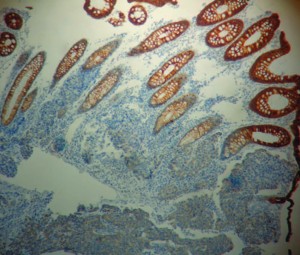
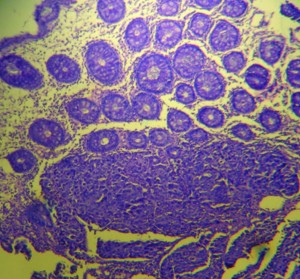
En la anatomía patológica con tinción de hematoxilina-eosina se observó una mucosa colónica con estructura glandular preservada que a nivel basal y submucoso presentaba una proliferación mamelonada infiltrante (Figura 3). Los anatomopatólogos, por contar con los antecedentes clínico-quirúrgicos de la paciente y observar que el hallazgo no era compatible con una lesión primaria de colon, deciden realizar IHQ para receptores estrogénicos: RE positivo (Figura 4), RP positivo, CK7 positivo, CK20 negativo (Figura 5), arribándose al diagnóstico de una metástasis de adenocarcinoma de mama.
Figura 3. Tinción con hematoxilina-eosina: mucosa colónica con estructura glandular preservada que a nivel basal y submucoso presenta una proliferación mamelonada infiltrante.
Se realizó una TC de tórax, abdomen y pelvis que informó una imagen ganglionar mesentérica de 18 mm en flanco derecho y una interconsulta con el Servicio de Cirugía General, quienes realizan una hemicolectomía derecha con criterio oncológico con íleo-transverso-anastomosis. La exploración quirúrgica de los órganos abdominales fue normal. A los 7 días, con evolución favorable, la paciente se externa.
La pieza de la hemicolectomía mostró a 1,5 cm de la válvula ileocecal, una formación tumoral de 3,2 x 2,5 cm. Microscópicamente correspondió a metástasis de adenocarcinoma mamario con infiltración de la capa muscular. De la grasa peritumoral se disecan 8 ganglios linfáticos, uno de ellos con metástasis de carcinoma (1/8). Se efectúa IHQ: RP positivo, RE positivo, CK7 positivo, CK20 positivo. HER2/neu negativo, Ki 67 elevado, Actina positivo.
En la tomografía computada de tórax, abdomen y pelvis con contraste oral y endovenoso se evidencian algunos ganglios subcentimétricos a nivel retrocavopretraqueal y una imagen nodular de aproximadamente 3,4 cm por 3,5 cm que ocupa el receso ácigo-esofágico, con aumento de tamaño del hilio pulmonar derecho, no descartándose la presencia de ganglios a dicho nivel. El resto del estudio fue normal. El Comité de Tumores del hospital interpreta que la imagen nodular corresponde a un conglomerado ganglionar metastásico.
Continúa seguimiento ambulatorio en el Servicio de Oncología iniciando tratamiento con fulvestrant.
A los 5 meses consulta nuevamente a la Unidad de Gastroenterología por epigastralgia de 3 meses de evolución con pobre respuesta a los inhibidores de la bomba de protones, en el contexto de ingesta prolongada de analgésicos no esteroideos por dolores articulares. Se realiza videoendoscopía digestiva alta, informándose: esófago con mucosa de aspecto normal. Estómago con mucosa congestiva en cuerpo y antro. A nivel de cuerpo, vertiente anterior de curvatura mayor, se observa una úlcera de aproximadamente 1 cm de diámetro de forma estrellada y fondo fibrinoso que se biopsia. Bulbo y segunda porción duodenal con mucosa de aspecto normal.
El estudio histológico mostró fragmentos de mucosa gástrica infiltrados por carcinoma con células en anillo de sello, vasocongestión y escaso componente linfocitario. Se efectúa IHQ: RE negativo, RP negativo, HER2 /neu negativo, CK 7 negativo, CK 20 positivo y Ki 67 elevado, haciéndose el diagnóstico de adenocarcinoma gástrico con células en anillo de sello.
El Comité de Tumores del hospital, evaluando todos los antecedentes de la paciente, consideró que tenía criterios para tratamiento paliativo e inicia terapia con capecitabina.
Discusión
El cáncer de mama es la primera causa de muerte por tumores en las mujeres. En Argentina, según datos del Instituto Nacional del Cáncer, se producen 5.400 muertes por año debido al cáncer de mama. Se estima que se producirán 18.000 nuevos casos por año. Su incidencia es de 74 casos por 100.000 mujeres, representando el 17,8% del total de la incidencia de cáncer en el país.
Los lugares más frecuentes de metástasis del cáncer de mama son los ganglios linfáticos, pulmones, hígado, cerebro y hueso, siendo muy rara la localización en el tubo digestivo y más rara aún la localización en el colon. No hay una incidencia clara con respecto a las metástasis gastrointestinales del cáncer de mama habiéndose publicado estudios de necropsias de pacientes fallecidos por cáncer de mama que encontraron tasas de metástasis gastrointestinales de casi un 30%1 contra otros que reportaron tan sólo un 0,6%.2 Tampoco hay claridad con respecto a los lugares del tubo digestivo en los que metastatizan con mayor frecuencia, pero hay reportes que colocan al estómago en primer lugar manifestándose como una linitis plástica,3, 4 seguido por el duodeno (6-18% de los casos), probablemente por la rica vascularización de ellos, y el colon en un 8 al 12% de los casos.5
El compromiso metastásico del colon, a partir de un tumor primario, es más frecuente que se dé de manera secundaria por proximidad de aquellos ubicados en la cavidad abdominal, siendo más infrecuente la vía linfática o hematógena como causal. Varios estudios reportan casos de metástasis en colon que siguen esta última vía, los cuales corresponden a melanomas, sarcomas, cánceres de pulmón, apareciendo también el de mama.6
Si consideramos el tipo de cáncer de mama diagnosticado, el lobulillar infiltrante es el que suele metastatizar con mayor frecuencia en el tubo digestivo7 y también lo hace en otros varios lugares incluyendo órganos ginecológicos, peritoneo y retroperitoneo; mientras que es raro que lo haga el de tipo ductal, que suele extenderse a pulmón, cerebro e hígado.8 Se calcula que puede encontrarse aproximadamente un 4,5% de metástasis gastrointestinales en el tipo lobulillar9 frente a un 1,1% del ductal infiltrante, encontrándose publicaciones en que la tasa del lobulillar es aún más baja, siendo del 0,2%.
Hay algunas series de pacientes publicadas como casos con metástasis en el tubo digestivo de cáncer de mama,10, 11 pero con casos aislados de los del tipo ductal, siendo casi todos correspondientes al tipo lobulillar.
El tiempo medio del diagnóstico de una metástasis en colon de un cáncer primario de mama fue de alrededor de 7 años, con el caso más temprano observado a los 4 meses12 y el más tardío a los 28 años13 luego del diagnóstico inicial.
Los pacientes con una metástasis en colon de un cáncer primario de mama pueden presentarse de manera completamente asintomática o si no con una sintomatología indistinguible de la de un tumor primario de colon. Si a este dato le sumamos el del tiempo que puede transcurrir entre el primario de mama y la metástasis, vemos que, muchas veces, un diagnóstico rápido suele ser dificultoso.
Las lesiones objetivables en una VCC también pueden variar desde procesos estenóticos difusos hasta lesiones ulceradas o nodulares similares a las observadas en un tumor primario de colon. Es interesante aclarar que el carcinoma lobulillar de mama tiende a causar lesiones metastásicas más bien infiltrativas difusas en el tubo gastrointestinal, mientras que el ductal suele causar lesiones nodulares.14
Hay que resaltar que estas lesiones suelen empezar infiltrando la serosa o la capa submucosa, por lo que las biopsias deben ser lo suficientemente profundas como para evitar que una toma demasiado superficial dé resultados anatomopatológicos erróneamente negativos.15
Los valores plasmáticos del antígeno carcinoembrionario en el cáncer de mama pueden estar elevados, por lo que su utilización como método diferencial entre tumor primario de colon o una metástasis del primero no es de gran utilidad.16
La IHQ es de gran importancia para este diagnóstico diferencial, con marcadores como el ER, RP, Her2/neu; teniendo en cuenta que se reportaron tasas de entre el 30 al 70% de cánceres primarios de colon que son ER positivos.17 De allí que el estudio de las citoqueratinas CK7/ CK20 adquieren relevancia.
Con respecto al mejor tratamiento de estos pacientes, aparentemente la cirugía no ofrece un mayor resultado positivo en la sobrevida, ya que siempre se trata de estadíos avanzados de la enfermedad y se reservaría para casos con cuadros oclusivos o hemorragias importantes. El manejo con terapia hormonal es posiblemente lo más indicado, aunque persiste cierta controversia al respecto y hay quienes prefieren el tratamiento quirúrgico junto con quimioterapia como en nuestro caso.18
No hemos hallado trabajos concluyentes con respecto al incremento de la incidencia del cáncer colorrectal primario en pacientes con historia personal de cáncer de mama.
Con respecto al diagnóstico posterior en nuestra paciente de un adenocarcinoma de estómago, entendemos que cumple con los criterios indicados para ser considerado como un caso de tumores primarios múltiples. La concomitancia del cáncer de mama y el de estómago puede suceder en el contexto del síndrome de cáncer gástrico difuso, lo cual está determinado por una mutación del gen CDH1, pero está definido para el tipo lobulillar.19
Mamounas y col presentaron un estudio de 1.382 autopsias en pacientes con cáncer de mama y otro tumor primario extramamario, y concluyeron que el 65% de ellos se presentó dentro de la primera década posterior al de mama, y que en un 10,6% de estos pacientes, el nuevo primario había sido mal interpretado como una metástasis de aquél.20
Conclusión
Presentamos un caso muy poco frecuente de una paciente con carcinoma ductal infiltrante de mama con metástasis en colon con posterior aparición de un adenocarcinoma de estómago.
Todos los estudios publicados coinciden en que un paciente que presenta síntomas gastrointestinales, teniendo como antecedente personal un cáncer de mama diagnosticado, debe estudiarse con endoscopías digestivas y realizar varias biopsias de cualquier lesión que pueda encontrarse. Debido a que las metástasis son predominantemente con compromiso seroso y submucoso, las lesiones pueden no llegar a ser objetivables o aparentar ser benignas; por esta causa, las biopsias deben ser profundas.
Referencias
- Weigelt B, Peterse JL, Van ‘t Veer LJ. Breast cancer metastasis: markers and models. Nat Rev Cancer 2005; 5: 591-602.
- McLemore EC, Pockaj BA, Reynolds C, Gray RJ, Hernandez JL, Grant CS, Donohue JH. Breast cancer: presentation and intervention in women with gastrointestinal metastasis and carcinomatosis. Ann Surg Oncol. 2005; 12: 886-894.
- Kim SY, Kim KW, Kim AY, Ha HK, Kim JS, Park SH, Kim JK, Kim MJ, Park SW, Lee MG. Bloodborne metastatic tumors to the gastrointestinal tract: CT findings with clinicopathologic correlation. AJR Am J Roentgenol 2006; 186: 1618-1626. Erratum in: AJR Am J Roentgenol 2009; 193: 284.
- Cormier WJ, Gaffey TA, Welch JM, Welch JS, Edmonson JH. Linitis plastic caused by metastatic lobular carcinoma of the breast. Mayo Clin Proc 1980; 55: 747-753.
- Cifuentes N, Pickren JW. Metastases from carcinoma of mammary gland: an autopsy study. J Surg Oncol 1979; 11: 193-205.
- Mourra N, Jouret-Mourin A, Lazure T, Audard V, Albiges L, Malbois M, Bouzourene H, Duvillard P. Metastatic tumors to the colon and rectum: a multi-institutional study. Arch Pathol Lab Med 2012; 136: 1397-1401.
- Borst MJ, Ingold JA. Metastatic patterns of invasive lobular versus invasive ductal carcinoma of the breast. Surgery 1993; 114: 637-641.
- Fondrinier E, Guérin O, Lorimier G. A comparative study of metastatic patterns of ductal and lobular carcinoma of the breast from two matched series (376 patients). Bull Cancer 1997; 84: 1101-1107.
- Arpino G, Bardou VJ, Clark GM, Elledge RM. Infiltrating lobular carcinoma of the breast: tumor characteristics and clinical outcome. Breast Cancer Res 2004; 6: R149-156.
- Voravud N, el-Naggar AK, Balch CM, Theriault RL. Metastatic lobular breast carcinoma simulating primary colon cancer. Am J Clin Oncol 1992; 15: 365-369.
- Rabau MY, Alon RJ, Werbin N, Yossipov Y. Colonic metastases from lobular carcinoma of the breast. Report of a case. Dis Colon Rectum 1988; 31: 401-402.
- Schwarz RE, Klimstra DS, Turnbull AD. Metastatic breast cancer masquerading as gastrointestinal primary. Am J Gastroenterol 1998; 93: 111-114.
- Theraux J, Bretagnol F, Guedj N, Cazals-Hatem D, Panis Y. Colorectal breast carcinoma metastasis diagnosed as an obstructive colonic primary tumor. A case report and review of the literature. Gastroenterol Clin Biol 2009; 33: 1114-1117.
- Pectasides D, Psyrri A, Pliarchopoulou K, Floros T, Papaxoinis G, Skondra M, Papatsibas G, Macheras A, Athanasas G, Arapantoni- Datioti P, Economopoulos T. Gastric metastases originating from breast cancer: report of 8 cases and review of the literature. Anticancer Res 2009; 29: 4759-4763.
- Nikkar-Esfahani A, Kumar BG, Aitken D, Wilson RG. Metastatic breast carcinoma presenting as a sigmoid stricture: report of a case and review of the literature. Case Rep Gastroenterol 2013; 7: 106-111.
- Pla V, Safont MJ, Buch E, Pallas A, Roig JV. Metástasis de carcinoma ductal infiltrante de mama simulando un cáncer de colon obstructivo primario. Cir Esp 2002; 71: 257-258.
- Kazim Uygun, Zafer Kocak, Semsi Altaner, Irfan Cicin, Fusun Tokatli, Cem Uzal Yonsei. Colonic Metastasis from Carcinoma of the Breast that Mimicks a Primary Intestinal Cancer. Med J 2006; 47: 578-582.
- Titi MA, Anabtawi A, Newland AD. Isolated gastrointestinal metastasis of breast carcinoma: a case report. Case Rep Med 2010; 2010: 615923.
- Herráiz M, Valentí V, Sola J, Pérez-Rojo P, Rotellar F, A.Cienfuegos J. Cáncer gástrico hereditario difuso: estrategias para disminuir el riesgo tumoral. Rev Esp Enferm Dig 2012; 104: 326-329.
- Mamounas EP, Perez-Mesa C, Penetrante RB, Driscoll DL, Blumenson LE, TsangarisTN. Patterns of occurrence of second primary non-mammary malignancies in breast cancer patients: results from 1,382 consecutive autopsies. Surg Oncol 1993; 2: 175-185.
Correspondencia: Fabián Ángel Precetti
Altolaguirre 1557 (1431), Ciudad Autónoma de Buenos Aires, Argentina
Tel/Fax: 011-45240969
Correo electrónico: fapre2004@yahoo.com.ar
Altolaguirre 1557 (1431), Ciudad Autónoma de Buenos Aires, Argentina
Tel/Fax: 011-45240969
Correo electrónico: fapre2004@yahoo.com.ar
Acta Gastroenterol Latinoam 2015;45(4):307-311