Es un blog de Jorge Figueroa Apestegui Medico Internista Residente de Gastroenterologia 2012-2015 HNGAI Magister en Salud Publica y Docencia Universitaria Universidad Nacional Mayor de San Marcos 1990-2004 CMP:34170 RNE:031011
martes, 6 de septiembre de 2016
jueves, 1 de septiembre de 2016
Acalasia
Fundamentos de la práctica
La acalasia es un trastorno de la motilidad esofágica primaria se caracteriza por la ausencia de peristaltismo esofágico y la alteración de la relajación del esfínter esofágico inferior (EEI) en respuesta a la deglución. El LES es hipertenso en aproximadamente 50% de los pacientes. Estas anomalías causan una obstrucción funcional en la unión gastroesofágica (UGE).
Signos y síntomas
Los síntomas de esta afección incluyen los siguientes:
- La disfagia (más común)
- regurgitación
- Dolor de pecho
- Acidez
- Pérdida de peso
El examen físico es no contributiva.
Ver presentación para más detalles.
Diagnóstico
Los estudios de laboratorio son no contributiva. Los estudios que pueden ser útiles incluyen los siguientes:
- La manometría esofágica (el estándar de oro): relajación incompleta del EEI en respuesta a la deglución, en reposo alta presión del EEI, el peristaltismo esofágico ausente
- El monitoreo del pH esofágico prolongado para descartar la enfermedad por reflujo gastroesofágico y determinar si el reflujo anormal está siendo causado por el tratamiento
- La endoscopia digestiva alta para descartar el cáncer de la UGE o fondo de ojo
- ultrasonografía endoscópica concomitante si se sospecha de un tumor
Ver Workup para obtener más detalles.
administración
El objetivo del tratamiento para la acalasia es aliviar los síntomas mediante la eliminación de la resistencia de salida causado por la hipertensión y nonrelaxing LES.
tratamientos no quirúrgicos farmacológicos y otros son los siguientes:
- La administración de bloqueadores de los canales de calcio y disminución de la presión del EEI nitratos (sobre todo en pacientes de edad avanzada que no pueden someterse a la dilatación neumática o cirugía)
- intraesfinteriana inyección endoscópica de la toxina botulínica bloquea la liberación de acetilcolina a nivel de la LES (sobre todo en pacientes de edad avanzada que no son buenos candidatos para la dilatación o cirugía)
El tratamiento quirúrgico incluye lo siguiente:
- Miotomía laparoscópica de Heller, preferiblemente con anterior (Dor; más común) o posterior (Toupet) fundoplicatura parcial
- Peroral miotomía endoscópica (POEMA)
Los pacientes en los que falla la cirugía pueden ser tratados con una dilatación endoscópica primero. Si esto no funciona, una segunda operación puede intentarse una vez que la causa de la falla se ha identificado con los estudios de imagen. La esofagectomía es el último recurso.
Ver tratamiento y la medicación para obtener más detalles.
Fondo
Sir Thomas Willis describió la acalasia en 1672. En 1881, von Mikulicz describió la enfermedad como un cardioespasmo para indicar que los síntomas se deben a un problema funcional en lugar de una mecánica. En 1929, Hurt y Rake se dio cuenta de que la enfermedad era causada por un fallo del esfínter esofágico inferior (EEI) para relajarse. Acuñaron el término acalasia, lo que significa el fracaso para relajarse.
Acalasia es un trastorno de la motilidad esofágica primario caracterizado por la ausencia de peristalsis esofágica y deterioro de la relajación LES en respuesta a la deglución. El LES es hipertenso en aproximadamente 50% de los pacientes. Estas anomalías causan una obstrucción funcional en la unión gastroesofágica. Ver las imágenes a continuación.
 Esofagografía que demuestra la apariencia de pájaro pico del esófago inferior, dilatación del esófago, y la estasis de bario en el esófago.
Esofagografía que demuestra la apariencia de pájaro pico del esófago inferior, dilatación del esófago, y la estasis de bario en el esófago.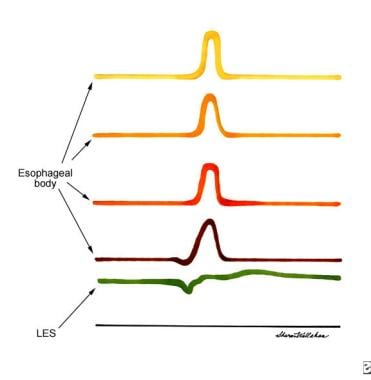 Evaluación manométrica del esófago en un paciente con acalasia. conclusiones pertinentes incluyen ausencia de peristaltismo propulsivo en el cuerpo del esófago (tenga en cuenta las contracciones simultáneas), elevada presión de reposo del esfínter esofágico inferior (LES), y la ausencia de relajación del EEI.
Evaluación manométrica del esófago en un paciente con acalasia. conclusiones pertinentes incluyen ausencia de peristaltismo propulsivo en el cuerpo del esófago (tenga en cuenta las contracciones simultáneas), elevada presión de reposo del esfínter esofágico inferior (LES), y la ausencia de relajación del EEI.fisiopatología
Presión LES y la relajación son regulados por excitatorios (por ejemplo, acetilcolina, sustancia P) y (por ejemplo, el óxido nítrico, el péptido intestinal vasoactivo) inhibidora de neurotransmisores. Las personas con acalasia carecen de células no adrenérgico, colinérgicas, inhibidores ganglionares, provocando un desequilibrio en excitatoria y la neurotransmisión inhibitoria. [1] El resultado es un esfínter esofágico nonrelaxed hipertensiva.
Etiología
Hay algunas pruebas de que la acalasia es una enfermedad autoinmune. [1, 2, 3] Un estudio europeo comparó ácido desoxirribonucleico relacionados con inmune (ADN) en las personas con acalasia con la de los controles y se encontró 33 polimorfismos de un solo nucleótido (SNP) asociados con acalasia. Todo el se encontraron en la región principal complejo de histocompatibilidad del cromosoma 6, una ubicación asociada con trastornos autoinmunes tales como esclerosis múltiple, lupus, y la diabetes tipo 1. [2, 3]
Epidemiología
incidencia Estados Unidos
La incidencia de la acalasia es de aproximadamente 1 por cada 100.000 personas por año.
La incidencia de la alteración de la motilidad esofágica parece aumentado en pacientes con lesión de la médula espinal (SCI). [4] En un estudio de 12 pacientes con paraplejia (nivel de la lesión entre T4-T12), 13 pacientes con tetraplejia (nivel de la lesión entre C5 C7), y 14 personas sin discapacidad, Radulovic et al encontró 21 de los 25 pacientes (84%) con SCI tenían al menos una anomalía de la motilidad esofágica en comparación con 1 de 14 sujetos sanos (7%). Entre las anomalías observadas en pacientes con SCI eran tipo acalasia II (12%), tipo III acalasia (4%), obstrucción esofagogástrica unión de salida (20%), el esófago hipercontráctil (4%), y anormalidades peristálticas (peristalsis débil con pequeño o grande defectos o peristaltismo fallado frecuente (48%)}. [4]
Alterado la motilidad esofágica se ve a veces en pacientes con anorexia nerviosa.[5] También se observa en los pacientes después de la erradicación de várices esofágicas por la escleroterapia endoscópica, en asociación con un mayor número de sesiones endoscópicas, pero no con los parámetros manométricos. [6] Características de la motilidad del esófago después de la escleroterapia endoscópica son un esfínter inferior defectuoso y el peristaltismo defectuoso y hipotensor.
datos internacionales
En un estudio retrospectivo (1990-2013) de los Países Bajos, la incidencia media de la acalasia en niños fue de 0,1 por cada 100.000 personas por año. [7] Las tasas de recaída después del tratamiento inicial fueron mayores en los que se sometieron pneumodilation (79%) que Heller miotomía (21%), pero la complicación se produjeron con más frecuencia después de la miotomía de Heller (55,6%) que con pneumodilation (1,5%).
La enfermedad de Chagas puede causar un trastorno similar a la acalasia.
Por sexo y datos demográficos relacionados con la edad
La razón hombre-mujer de la acalasia es 1: 1.
La acalasia se produce normalmente en adultos de 25-60 años. Menos del 5% de los casos ocurren en niños.
Historia y examen físico
Acalasia se caracteriza por los siguientes síntomas y signos [8] :
- La disfagia (más común)
- regurgitación
- Dolor de pecho
- Acidez
- Pérdida de peso
El examen físico es no contributiva.
La invasión de los plexos neuronales del esófago por el tumor puede causar no relajación del EEI, imitando así la acalasia. Esta condición se conoce como seudoacalasia maligno. Desde la radiografía de contraste y la endoscopia con frecuencia dejar de diferenciar estas 2 entidades, los pacientes con un diagnóstico presuntivo de la acalasia, pero que tienen una menor duración de los síntomas, mayor pérdida de peso, y una edad más avanzada y que están referidos para cirugía mínimamente invasiva deben ser sometidos a imágenes adicionales estudios, incluyendo la ecografía endoscópica y tomografía computarizada con cortes finos de la unión gastroesofágica, para descartar el cáncer.
La dilatación neumática para la acalasia conlleva un riesgo significativo y reconocido de perforación esofágica. Por lo tanto, un consentimiento informado enfatizando este riesgo de perforación debe ser obtenido de los pacientes antes de la dilatación.
Después de la dilatación, administrar una pequeña cantidad de material de contraste hidrosoluble para evaluar la perforación. Esto debe realizarse en todos los pacientes que se someten al procedimiento. Si no se observa la perforación, la dieta del paciente se puede hacer avanzar lentamente después de un período de observación.
Los pacientes con una pequeña perforación sin ninguna evidencia de infección o la comunicación con las cavidades pleural y peritoneal pueden recibir tratamiento conservador con antibióticos de amplio espectro y estrecha observación en el hospital.
Una consulta con el cirujano debe obtenerse tan pronto como se identifique una perforación. Cualquier deterioro clínico o la comunicación con el mediastino o cavidades pleural y peritoneal precisa de intervención quirúrgica.
Consideraciones de aproximación
Un diagnóstico de la acalasia debe ser considerado cuando los pacientes presentan disfagia, dolor en el pecho, y los síntomas de reflujo refractarios después de una endoscopia no revela una obstrucción mecánica o una causa inflamatoria de los síntomas esofágicos. [9]
El Colegio Americano de Gastroenterología publicó nuevas directrices para el diagnóstico y tratamiento de la acalasia en julio de 2013. [10, 11] Recomendaciones para el diagnóstico correcto de la enfermedad incluyen los siguientes:
- Realización de una prueba de motilidad esofágica en todos los pacientes con sospecha de la acalasia
- Utilizando los resultados Esofagrama para apoyar un diagnóstico
- Usando esofagograma de bario, como se recomienda para pacientes con pruebas de la motilidad equívoca
- evaluación endoscópica del cardias gástrico y la unión gastroesofágica, tal como se recomienda, para descartar seudoacalasia
Los estudios de laboratorio son por lo general no contributiva.
La topografía de la presión esofágica (EPT) puede ser la modalidad de evaluación preferida de la motilidad esofágica sobre trazados de líneas convencionales (CLT).[12] Seis gastroenterólogos que asisten y seis compañeros de gastroenterología de 3 centros académicos interpretados cada uno de los 40 estudios que utilizaron ambos formatos EPT y CLT: entre todos los evaluadores, las probabilidades de un diagnóstico exacto de la motilidad esofágica incorrectos eran 3,3 veces más alta con CLT que con la EPT, y las probabilidades de una incorrecta identificación de un trastorno de la motilidad eran 3,4 veces más alta con CLT que con la EPT.
Estudios de imagen
trago de bario
El esófago se ve dilatado, y el material de contraste pasa lentamente en el estómago como el LES se abre intermitentemente. El esófago distal se estrecha y se ha descrito como parecido a un pico de ave (ver la imagen de abajo).
otras pruebas
La manometría esofágica (ver la imagen de abajo) es el estándar de oro para ayudar a diagnosticar los signos clásicos de la acalasia. [13] Estos resultados incluyen los siguientes:
- relajación incompleta del EEI en respuesta a la deglución
- En reposo alta presión del EEI
- peristalsis esofágica Ausente
 Evaluación manométrica del esófago en un paciente con acalasia. conclusiones pertinentes incluyen ausencia de peristaltismo propulsivo en el cuerpo del esófago (tenga en cuenta las contracciones simultáneas), elevada presión de reposo del esfínter esofágico inferior (LES), y la ausencia de relajación del EEI.
Evaluación manométrica del esófago en un paciente con acalasia. conclusiones pertinentes incluyen ausencia de peristaltismo propulsivo en el cuerpo del esófago (tenga en cuenta las contracciones simultáneas), elevada presión de reposo del esfínter esofágico inferior (LES), y la ausencia de relajación del EEI.
El monitoreo del pH esofágico prolongado es importante por las siguientes razones:
- Para descartar la enfermedad por reflujo gastroesofágico (ERGE)
- Para determinar si el reflujo anormal está siendo causado por el tratamiento.[14]
procedimientos
Realizar una endoscopia digestiva alta (EGD) para descartar el cáncer de la unión gastroesofágica o de fondo de ojo. Si se sospecha un tumor, realizar una ecografía endoscópica, al mismo tiempo.
Consideraciones de aproximación
El Colegio Americano de Gastroenterología publicó nuevas directrices para el diagnóstico y tratamiento de la acalasia en julio de 2013. [10, 11] Las recomendaciones de tratamiento son los siguientes:
- El tratamiento inicial debe ser clasificado ya sea la dilatación neumática (DN) o la miotomía laparoscópica quirúrgica con una fundoplicatura parcial en pacientes aptos para someterse a la cirugía
- Los procedimientos deben ser realizados en centros de alto volumen de excelencia
- la elección de la terapia inicial debe basarse en la edad del paciente, sexo, preferencia y experiencia institucional local
- Se recomienda la terapia con toxina botulínica para pacientes no se adapta a la EP o cirugía
- El tratamiento farmacológico puede ser utilizado para los pacientes no sometidos a PD o miotomía y que han fracasado con la terapia de toxina botulínica (nitratos y bloqueadores de los canales de calcio más comunes)
Atención médica
El objetivo del tratamiento para la acalasia es aliviar los síntomas mediante la eliminación de la resistencia de salida causado por la hipertensión y nonrelaxing LES. Una vez que la obstrucción se resuelve, el bolo alimenticio puede viajar a través del cuerpo aperistáltico del esófago por la gravedad.
bloqueadores de los canales de calcio y los nitratos se utilizan para disminuir la presión del EEI. Aproximadamente el 10% de los pacientes se benefician de este tratamiento. Este tratamiento se utiliza sobre todo en pacientes de edad avanzada que tienen contraindicaciones a cualquiera de dilatación neumática o cirugía.
El tratamiento endoscópico incluye una inyección intraesfinteriana de la toxina botulínica para bloquear la liberación de acetilcolina a nivel de la LES, restaurando así el equilibrio entre la excitación e neurotransmisores inhibidores. [15] Este tratamiento tiene un valor limitado. Sólo el 30% de los pacientes tratados endoscópicamente todavía tienen el alivio de la disfagia 1 año después del tratamiento. La mayoría de los pacientes necesitan inyecciones repetidas de toxina botulínica, con beneficios clínicos de corta duración. Este tratamiento puede causar una reacción inflamatoria en el nivel de la unión gastroesofágica, haciendo una miotomía posterior muy difícil. En comparación con la dilatación neumática, la inyección de toxina botulínica se asocia con tasas de recurrencia de síntomas significativamente superiores a los 12 meses. [16] Del mismo modo, esta modalidad de tratamiento es menos eficaz que laparoscópica miotomía de Heller a los 2 años de seguimiento. [17] utilizar este tratamiento en pacientes de edad avanzada que no son buenos candidatos para la dilatación o la cirugía.
La dilatación neumática realizado por un gastroenterólogo cualificado es el tratamiento recomendado en los casos esporádicos en los que la cirugía no es apropiado. [18] Un globo se infla en el nivel de la unión gastroesofágica a la ruptura a ciegas las fibras musculares, dejando intacta la mucosa. La tasa de éxito es del 70-80%, y la tasa de perforación es de aproximadamente 5%. Si se produce una perforación, se necesita cirugía de emergencia para cerrar la perforación y para realizar una miotomía. Hasta el 50% de los pacientes puede requerir más de 1 dilatación. La incidencia del reflujo gastroesofágico patológico después del procedimiento es de aproximadamente 30%.
Un miotomía de Heller laparoscópica es considerado por muchos como el principal tratamiento adecuado de los pacientes con acalasia (véase la atención quirúrgica).Un miotomía de Heller y funduplicatura parcial realizado desde el pecho (toracoscopia) tienen una alta incidencia de reflujo gastroesofágico. [19]
Peroral miotomía endoscópica (POEMA) se ha introducido hace relativamente poco tiempo como un enfoque novedoso para la acalasia. [20, 21] Este procedimiento se realiza bajo anestesia general con intubación endotraqueal. A 2 cm de la incisión de la mucosa longitudinal se realiza sobre la superficie de la mucosa para crear una entrada de la mucosa a la submucosa espacio. Un túnel submucoso anterior se crea hacia abajo, pasando por la unión gastroesofágica y unos 3 cm en el estómago proximal. Una vez completado el túnel submucoso, la sección de las fibras musculares circulares comienza 2-3 cm distal a la entrada de la mucosa, de aproximadamente 7 cm por encima de la unión gastroesofágica. La miotomía se continúa paso a paso en sentido distal hasta que se alcanza la submucosa gástrica, que se extiende aproximadamente 2-3 cm distal a la unión gastroesofágica. Después de la identificación y la sección de las fibras musculares circulares de la parte inferior del esófago y el estómago proximal, el sitio de entrada de la mucosa se cierra con clips hemostáticos.
Se han propuesto varias ventajas potenciales de POEMA comparación con laparoscópica miotomía de Heller. El abordaje endoscópico debe reducir al mínimo el dolor postoperatorio en teoría. Un miotomía ya se puede realizar, se extiende hasta el tercio medio del esófago, justo por debajo del arco aórtico. Una cirugía antirreflujo concomitante puede no ser necesaria debido a la sección selectiva de las fibras musculares circulares sin disección al nivel de la unión gastroesofágica.En la práctica actual, se dispone de pocos datos con respecto a los resultados clínicos en pequeñas series de pacientes mayores períodos de seguimiento muy cortos.
En un estudio comparativo que evaluó los resultados sintomáticos y objetivas de la de la laparoscopia miotomía de Heller con el poema para la acalasia, Bhayani et al informaron de una hospitalización más corta en los que se sometieron POEMA que aquellos que se sometieron a miotomía, pero ambos procedimientos mostró una mejoría equivalente en los síntomas y la fisiología de esófago así como la exposición esofágica al ácido postoperatoria equivalente. [22] Worrell et al informaron de resultados similares. [23]
Sobre la base de las limitadas pruebas disponibles, poema parece ser un procedimiento prometedor. Sin embargo, hay algunas preocupaciones acerca de esta técnica. Miotomía endoscópica es un procedimiento muy exigente, que requiere grandes habilidades, con una curva de aprendizaje muy largo. A pesar de que varios estudios han informado de una reducción significativa de la presión LES como se demuestra por manometría, la presión LES era a menudo entre 15 y 20 mm Hg. Se sabe que un predictor de éxito a largo plazo es una presión LES alrededor de 10 mm Hg. [24] El reflujo gastroesofágico se informa en hasta el 50% de los pacientes después de POEMA, replicando los resultados obtenidos cuando una miotomía solo se realizó sin un antirreflujo operación. Revisión quirúrgica en pacientes con disfagia recurrente después POEMA podría ser un reto. La presencia de adherencias entre el submucosa y las capas musculares longitudinales después de POEMA podría hacer la disección a este nivel muy difícil.
Cuidado quirúrgico
Debido a excelentes resultados, una estancia hospitalaria más corta, y un rápido tiempo de recuperación, el tratamiento primario es considerado por muchos como una miotomía laparoscópica de Heller y funduplicatura parcial. En la experiencia del autor, y en la experiencia de muchos autores, este tratamiento proporciona un buen equilibrio en el alivio de los síntomas de la disfagia mediante la realización de la miotomía y en la prevención de reflujo gastroesofágico mediante la adición de una envoltura parcial. [25, 26] Un estudio prospectivo, aleatorizado de Vanderbilt Universidad indicó que existe un riesgo significativamente menor de reflujo postoperatorio después de una miotomía de Heller más una fundoplicatura parcial que existe después de una miotomía de Heller por sí sola. [27] Los autores de este estudio también demostró que en pacientes con acalasia, la adición de una fundoplicatura parcial no sólo es más eficaz en la prevención de reflujo postoperatorio, pero también es más rentable en un horizonte temporal de 10 años. [28]
Una fundoplicatura parcial añadido a la miotomía implica mejores resultados funcionales en comparación con una fundoplicatura total, con un menor riesgo de disfagia persistente o recurrente. [29] Recientemente, un ensayo multicéntrico, controlado que compara parcial anterior (Dor) con posterior parcial al azar (Toupet ) fundoplicatura no encontró diferencias significativas en cuanto a la incidencia postoperatoria de reflujo gastroesofágico. [30] en la práctica actual, una fundoplicatura parcial anterior se realiza con mayor frecuencia, ya que es más sencillo de realizar y cubre la mucosa esofágica expuesta. [31]
En el Ensayo Europeo de acalasia, el tratamiento con dilatación neumática o miotomía de Heller laparoscópica fue exitosa en un mayor porcentaje de pacientes con acalasia tipo II que en pacientes con el tipo I o forma de la enfermedad III. A pesar de que las tasas de éxito eran altos para ambos enfoques en la acalasia tipo II, la tasa de éxito fue significativamente mayor en el grupo tratado con dilatación neumática. [32] Sin embargo, la recaída es común después de la dilatación neumática. Para obtener buenos resultados a largo plazo, se requiere un seguimiento cercano y la dilatación de repetición. [33]
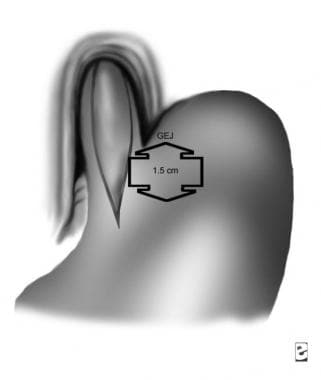
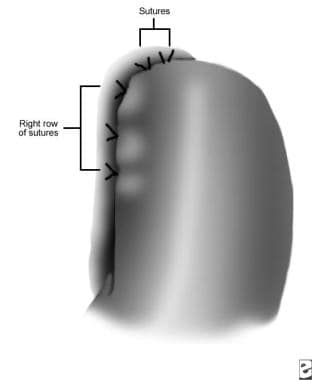
La cirugía mínimamente invasiva para la acalasia se realiza bajo anestesia general con el uso de 5 trócares. Una división controlada de las fibras musculares (miotomía) de la parte inferior del esófago (5 cm) y el estómago proximal (1,5 cm) se lleva a cabo, seguido de una fundoplicatura parcial para prevenir el reflujo. Ver las imágenes a continuación.
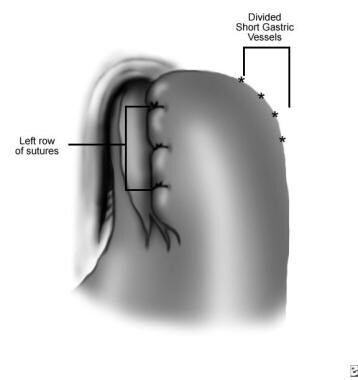 fundoplicatura de Dor, fila izquierda de suturas (después de la división de los vasos gástricos cortos).
fundoplicatura de Dor, fila izquierda de suturas (después de la división de los vasos gástricos cortos).
Los pacientes permanecen hospitalizados durante 24-48 horas y regresan a sus actividades normales en aproximadamente 2 semanas.
La operación alivia los síntomas en el 85-95% de los pacientes, y la incidencia de reflujo postoperatorio es de aproximadamente 20%.
Para pacientes en los que falla la cirugía, pueden ser tratados con una dilatación endoscópica primero. Si esto no funciona, una segunda operación (extensión de la miotomía anterior en la pared anterior del estómago) puede intentarse una vez que la causa de la falla se ha identificado con los estudios de imagen. El último recurso es eliminar quirúrgicamente el esófago (es decir, la esofagectomía).
Las opciones de tratamiento varían para los pacientes con diferentes grados de severidad de la enfermedad. Un estudio realizado por Reynoso et al sugiere que entre los pacientes hospitalizados con enfermedad de gravedad leve / moderada, miotomía laparoscópica para la acalasia mostró resultados comparables o mejores que la dilatación esofágica. [34] Para una mayor gravedad de la enfermedad / extremo, la dilatación mostraron un perfil comparable o mejor para hospitalizado pacientes con acalasia.
Esofagectomía fue el tratamiento estándar en pacientes con acalasia y un esófago en forma de sigma-marcadamente dilatados o, con miotomía de Heller considerado ineficaz en estos casos. Sin embargo, en un estudio realizado por Dulce y colegas de 113 pacientes con acalasia, los investigadores informaron que (1) en la mayoría de los pacientes del estudio, incluso aquellos con acalasia y un esófago dilatado, una disfagia laparoscópica miotomía de Heller aliviado; Se necesitaba (2) de tratamiento adicional en aproximadamente 20% de los pacientes; y (3) en el extremo, el 90% de los pacientes había alcanzado una buena capacidad de deglución. Esofagectomía no era necesario en ninguno de los pacientes para mantener la deglución clínicamente adecuada. [35]
Cowgill et al informaron sobre los resultados en 47 pacientes de más de 10 años después de la miotomía de Heller laparoscópica para la acalasia. [36] Se encontró que las complicaciones notables fueron poco frecuentes después del procedimiento y que no se habían producido muertes perioperatorias. Un paciente se sometió a una segunda miotomía 5 años después de la primera, debido a la recurrencia de los síntomas. Hubo 33 pacientes que sobrevivieron en el momento del estudio; los autores informaron que los otros pacientes murieron de causas no relacionadas con la miotomía. Utilizando una escala de Likert y Wilcoxon de pares coincidentes de los ensayos para evaluar los síntomas de los pacientes antes y después de la miotomía laparoscópica, Cowgill et al descubierto después de la cirugía significativa disminución en la frecuencia y severidad puntuaciones de disfagia, dolor de pecho, vómitos, regurgitación, asfixia, y ardor de estómago. Llegaron a la conclusión de que "los síntomas de la acalasia se forma duradera mejoran por vía laparoscópica de Heller durante la evaluación de seguimiento a largo plazo."
En comparación con la dilatación neumática, laparoscópica miotomía de Heller se asocia con mejores resultados en términos de mejoría de la disfagia y las tasas postoperatorias reflujo gastroesofágico, con un riesgo significativamente menor de reintervención. [37] A pesar de que los resultados son similares a corto plazo de seguimiento , [38] a largo plazo de seguimiento muestra que la mayoría de los pacientes después de la cirugía son asintomáticos, en comparación con sólo el 50% de los pacientes, incluso después de múltiples dilataciones neumáticas. [39]
Varios estudios han demostrado mejores resultados después de la miotomía de Heller laparoscópica de la dilatación neumática en pacientes menores de 40 años.[38] Además, el tratamiento endoscópico anterior, tales como la inyección de toxina botulínica o la dilatación neumática, puede comprometer el resultado clínico de la miotomía de Heller laparoscópica. La tasa de complicaciones intraoperatorias mayores y peores resultados a largo plazo de la cirugía laparoscópica de Heller se han reportado en varias series de pacientes tratados previamente con tratamientos endoscópicos. Estos hallazgos pueden estar relacionados con tejido cicatrizal en el nivel de la unión gastroesofágica, lo que hace la disección quirúrgica de los planos anatómicos mucho más difícil. [40, 41]
En 2011, Boeckxstaens et al [38] informó de los resultados de un estudio multicéntrico, aleatorizado comparando la dilatación neumática (95 pacientes) a miotomía de Heller laparoscópica con funduplicatura de Dor (106 pacientes) para la acalasia esofágica sin tratar. La tasa de perforación durante la dilatación neumática y la miotomía de Heller laparoscópica fue del 4% y 12%, respectivamente. El éxito terapéutico se define como una disminución en Eckardt puntuación por debajo de 3. El estudio mostró tasas de éxito similares después de la miotomía de Heller laparoscópica (90%) y la dilatación neumática (86%) durante un período de seguimiento de 2 años.
En conclusión, mientras que la dilatación neumática fue considerado como el principal modalidad de tratamiento para los pacientes con acalasia en la década de 1980, con la cirugía que tiene un papel secundario en caso de fallo de la dilatación,[42, 43] , en la práctica la dilatación neumática actual debería reservarse para cuando la experiencia quirúrgica es no disponible y para el tratamiento de la disfagia recurrente después de la miotomía.
Un estudio sólo se ha comparado en un poema de manera retrospectiva y laparoscópica miotomía de Heller. [44] Dieciocho pacientes sometidos a POEMA se compararon de manera no aleatorizada de 55 pacientes tratados por vía laparoscópica miotomía de Heller. No se observaron diferencias en cuanto a la longitud de la miotomía, la tasa de complicaciones, y la duración de la estancia hospitalaria. Se requiere Veress descompresión aguja de neumoperitoneo durante la intervención en 7 (39%) pacientes sometidos poema. El éxito del tratamiento (puntuación Eckardt ≤3) después POEMA se logró en 16 (89%) de los pacientes en la mediana de 6 meses de seguimiento. Seis semanas después del poema, manometría rutina de seguimiento y temporizado-esofagrama se observó la normalización de las presiones unión esofagogástrica y alturas de columna de contraste.
Sólo a largo plazo de seguimiento y los ensayos prospectivos que compararon poema con miotomía de Heller laparoscópica y fundoplicatura determinarán el papel de esta nueva técnica en el tratamiento de la acalasia esofágica.
Resumen medicamentos
Los antagonistas del calcio y nitratos tanto disminución de presión LES, pero no mejoran la relajación del EEI. Aproximadamente el 10% de los pacientes se benefician de un tratamiento médico, que debe ser usado principalmente en pacientes de edad avanzada que tienen contraindicaciones a cualquiera de dilatación neumática o la cirugía o como una medida temporal, mientras que otros tratamientos son considerados. [45]
Bloqueadores de los canales de calcio
Resumen de clases
Estos agentes interfieren con la absorción de calcio por las células de músculo liso que son dependientes de calcio intracelular para la contracción. Tienen un efecto relajante sobre el músculo del EEI.
Nifedipina (Adalat)
Inhibe la afluencia transmembrana de iones de calcio en el músculo liso, que, a su vez, inhibe la contracción de las fibras musculares.
Los nitratos
Resumen de clases
Estos agentes de relajar el músculo liso vascular.
Dinitrato de isosorbida (Isordil)
Tiene un efecto relajante sobre las fibras musculares lisas de LES. Relaja el músculo liso vascular mediante la estimulación de GMP cíclico intracelular.
Pronóstico
La dilatación neumática y la miotomía laparoscópica son eficaces para el manejo de la acalasia. Si se dispone de suficiente experiencia, se prefiere la cirugía.
No use la toxina botulínica y medicamentos si se realiza una dilatación neumática o miotomía de Heller laparoscópica.
Linaclotide
TITULO : Primeros Datos acerca de la Aprobación de Linaclotide
AUTOR : McWilliams V, Whiteside G, McKeage K
TITULO ORIGINAL : Linaclotide: First Global Approval
CITA : Drugs 72(16):2167-2175, 2012
MICRO : El linaclotide es la primera droga aprobada del grupo de los agonistas de la guanilil ciclasa C; se administra oralmente en forma diaria, y se utiliza en la forma constipada del síndrome de colon irritable y en la constipación idiopática crónica.
Las opciones actuales para el tratamiento del síndrome de intestino irritable a predominio de constipación (SII-C) y de la constipación idiopática crónica son limitadas e incluyen modificaciones del estilo de vida, laxantes lubricantes, osmóticos y estimulantes, y agonistas de los canales de cloro como el lubiprostone. Debido a que en muchos pacientes el manejo con estos tratamientos a menudo suele ser subóptimo, es necesario desarrollar nuevos medicamentos.
El linaclotide es un agonista de la guanidil ciclasa G desarrollado para tratar los trastornos gastrointestinales como el SII-C y la constipación idiopática crónica.
La aprobación se logró a partir de la realización de cuatro ensayos clínicos. Dos trabajos incluyeron con pacientes con SII-C, en los que se utilizó linaclotide en una dosis diaria de 290 µg; las otras dos investigaciones evaluaron el fármaco en la constipación idiopática crónica, con una dosis diaria de 145 µg.
Durante los estudios preclínicos, se observaron muertes en ratones jóvenes tras la administración de la droga, lo que motivó que no sea indicado para pacientes pediátricos de entre 6 y 17 años de edad. El linaclotide está contraindicado en pacientes pediátricos menores de 6 años y en pacientes pediátricos con sospecha de obstrucción gastrointestinal mecánica. Está caracterizado como categoría C para el embarazo, según la Food and Drug Administration.
En los estudios mencionados se evaluaron dos criterios combinados de valoración combinados, compuestos por la presencia de dolor abdominal y el informe de movimientos intestinales espontáneos completos. El primer criterio consistió en una reducción de por lo menos 30% en el dolor abdominal, en comparación con el dato basal, y un incremento de tres o más movimientos intestinales espontáneos completos por semana, con un aumento de 1 o más en la misma semana, por al menos 9 a 12 semanas de tratamiento. El segundo criterio consistía en una reducción del al menos el 30% del dolor abdominal y un aumento de al menos un movimiento intestinal espontáneo completo por semana, en la misma semana, por al menos 6 a 12 semanas de tratamiento. La tercera variable se definió como la reducción de al menos 30% del dolor en comparación con dolor basal en las semanas 9 a 12, y la última variable, como la presencia de al menos tres movimientos intestinales espontáneos completos, con un aumento de al menos uno por semana, durante 9 a 12 semanas de tratamiento. También se evaluó el puntaje de dolor abdominal y el alivio que produjo el tratamiento, en términos de "considerablemente aliviado" o "completamente aliviado", en ambos casos, en un período de 6 a 12 semanas.
En relación con la farmacodinamia, el linaclotide tiene efectos dependientes de la dosis en relación con la consistencia de las heces, la frecuencia y facilidad de las deposiciones y el peso de las heces, durante un curso de 7 días de tratamiento, según se informó en un estudio en fase Ib, con dosis múltiples, que se realizó con voluntarios sanos. En los estudios en modelos con animales, se informó que el linaclotide incrementó el tiempo de tránsito gastrointestinal y la secreción de fluidos intestinales. También se observó un aumento de los niveles de monofosfato de guanilil ciclasa en la cara luminal del duodeno y el yeyuno. En un ensayo clínico con linaclotide por vía oral no se comprobó que haya exposición sistémica de la droga ni de sus metabolitos. Tampoco se detectaron niveles sistémicos en un ensayo de dosis única incremental. La biodisponibilidad oral en ratas fue del 0.1%, y el fármaco fue resistente al pH gástrico y a la acción hidrolítica de la pepsina.
En los ensayos realizados en el SII-C, el linaclotide mejoró en forma estadísticamente significativa todos los resultados evaluados en un estudio en fase III luego de 12 semanas. Los pacientes que recibieron linaclotide alcanzaron la primera variable de resultado en un porcentaje de 12.7% en comparación con 3.0% del grupo placebo (p < 0.0001), y en la segunda variable, de 33.7% frente a 13.9% en el grupo placebo (p < 0.0001). En relación con las variables 3 y 4, los resultados fueron superiores en el grupo con linaclotide, 38.9% contra 19.6% (p < 0.0001), y 18% frente a 5% (p < 0.0001), respectivamente. Los resultados de los grupos fueron similares hacia la semana 26 de tratamiento. Además, el 54.1% de los pacientes que recibieron linaclotide informaron menos dolor e incomodidad respecto del 38.5% del grupo placebo (p < 0.0001) y consideraron un alivio completo de los síntomas en el 39.4%versus el 16.6% del grupo que recibió placebo (p < 0.0001).
En un estudio en fase III, el LIND-MD-31, los pacientes que recibieron linaclotide informaron una mejoría en todas las variables de estudio evaluadas. De acuerdo con un análisis que utilizó los datos de ambos estudios en conjunto, el linaclotide mejoró los síntomas de SII-C e incrementó considerablemente el porcentaje de días sin síntomas. El linaclotide mejoró significativamente la calidad de vida en siete de los ocho dominios evaluados. También disminuyó la pérdida de productividad y la alteración de la actividad diaria, en comparación con placebo. El linaclotide en dosis de 100 o 1 000 µg por día produjo un aumento del tránsito intestinal a las 48 horas de la dosis, mejorando significativamente la función intestinal, definida por la consistencia de las heces, la frecuencia en las deposiciones, el esfuerzo y el tiempo hasta el primer movimiento intestinal, en un estudio en fase II.
En relación con la constipación idiopática crónica, los pacientes tratados con linaclotide en dosis de 145 a 290 µg por día, alcanzaron un aumento significativo en cuanto a las primeras tres variables evaluadas, en comparación con el grupo placebo, en un estudio de fase III. El tratamiento con linaclotide también mejoró significativamente las variables secundarias evaluadas, como hinchazón, incomodidad abdominal, promedio semanal de movimientos intestinales espontáneos completos, consistencia de las heces, esfuerzo en la deposición y gravedad de la constipación. Más aun, el linaclotide se asoció con mejor calidad de vida, evaluada con el cuestionario de constipación. El linaclotide en una dosis de 75, 150, 300 o 600 µg por día durante cuatro semanas mejoró significativamente la constipación idiopática crónica en forma dependiente de la dosis.
En los estudios realizados en el SII-C, el linaclotide fue generalmente bien tolerado en los ensayos clínicos en fase III, el evento adverso más frecuente fue la diarrea: 19.7%versus 2.5% en el grupo placebo, y una tasa superior de abandono del tratamiento debido a los eventos adversos, 10.2% versus 2.5% en el grupo placebo. En otro estudio clínico, el uso de linaclotide se asoció con diarrea, en un 19.5% versus 3.5% del grupo placebo; flatulencia: 5% frente a 2%; dolor abdominal: 5% contra 3%, y cefaleas: 5% versus 4%. En un ensayo clínico en fase IIb la diarrea leva a moderada fue el evento adverso más común y se observó de forma dependiente de la dosis. En los estudios que analizaron el uso de linaclotide en la constipación idiopática crónica, el fármaco se asoció con diarrea, flatulencia, dolor abdominal y distensión abdominal en los ensayos en fase III. En estos estudios también se observó que la diarrea fue dependiente de la dosis y fue el motivo más frecuente por el cual los pacientes abandonaron el tratamiento.
El linaclotide recibió la primera aprobación para el tratamiento del SII-C y la constipación idiopática crónica.
Ref : FARMA, GASTRO.
Resumen objetivo elaborado por el
Comité de Redacción Científica de SIIC
en base al artículo original completo
publicado por la fuente editorial.
Comité de Redacción Científica de SIIC
en base al artículo original completo
publicado por la fuente editorial.
Sociedad Iberoamericana de Información Científica (SIIC)
2002
2002
Lubiprostone
COMUNICADO: AMITIZA(TM) (lubiprostone) demuestra su eficacia en el tratamiento de mayores de 65 años
- 8:55 - 21/09/2006
BETHESDA, Maryland, September 21 /PRNewswire/ --
-- AMITIZA(TM) (lubiprostone) es eficaz en el tratamiento del estreñimiento idiopático crónico en personas mayores de 65 años
Los resultados de un estudio han demostrado que AMITIZA(TM) (lubiprostone), el primer activador selectivo del canal cloruro para el tratamiento del estreñimiento idiopático crónico, ha conseguido la eficacia y se ha tolerado correctamente en lo que respecta al alivio de los síntomas del estreñimiento idiopático crónico en la población adulta, presentado en la Reunión Conjunta 2006 de la Sociedad Internacional de Neurogastroenterología y Motilidad celebrada en Boston. Se cree que 30 millones de americanos padecen estreñimiento, y esta enfermedad es más recurrente entre los adultos de más de 65 años.
"El estreñimiento es una enfermedad gastrointestinal común y molesta, y es especialmente prevalente entre la población de más de 65 años. A pesar de su prevalencia, estos pacientes mayores tienen unas opciones de tratamiento limitadas, y AMITIZA presenta una nueva opción terapéutica para esta población necesitada de tratamiento", comentó el doctor John Morley, MBCh, director de Geriatría y director interino de Endocrinología de la St. Louis University Medical School, St. Louis, MO.
AMITIZA cuenta con un nuevo mecanismo de acción que trabaja aumentando la secreción de los fluidos del intestino delgado, activando los canales de cloruro ClC-2 y consiguiendo una mejora de la calidad de las deposiciones, además de mejorar los síntomas asociados al estreñimiento crónico. AMITIZA es el único medicamento con prescripción para el estreñimiento idopático crónico que ha recibido la aprobación para su utilización en pacientes mayores y que puede ser utilizado por un periodo superior a las dos semanas.
AMITIZA, que recibió la aprobación de la Administración de Fármacos y Alimentos de EE.UU. (FDA) en enero de 2006, fue desarrollado por Sucampo Pharmaceuticals, Inc., y se comercializa de forma conjunta en EE.UU. por Sucampo y Takeda Pharmaceuticals North America, Inc.
Diseño del estudio
Para evaluar el alivio de los síntomas y el perfil de seguridad de AMITIZA entre la población adulta se han estudiado los datos de 3 estudios clínicos a corto plazo (3-4 semanas) para conseguir un grupo de adultos adecuado de más de 65 años. En total se han incluido 57 pacientes en el análisis: 26 participantes recibieron AMITIZA 24 mcg dos veces al día, y 31 participantes recibieron un tratamiento basado en placebo.
Los descubrimientos han revelado que los cambios medios frente a la línea base de los movimientos espontáneos del intestino (SBMs) fueron bastante mayores en el grupo tratado con AMITIZA (4,6-5,4 adicional de SBMs por semana) frente al grupo tratado con placebo (1,3-2,3 SBMs por semana) durante las semanas 1, 3 y 4 (P menor que o igual a 0,0286). Las mejoras de la consistencia de las deposiciones y de la tasa de contracciones intestinales también se consiguieron en los pacientes que tomaron AMITIZA frente a los que basaron su tratamiento en la toma de un placebo. Además, fueron pocos los pacientes del grupo tratado con AMITIZA los que experimentaron efectos secundarios adversos (46,2%) en comparación con los pacientes tratados con placebo (61,3%), un resultado que fue inverso en el subgrupo de pacientes no mayores (65,7% AMITIZA frente al 40,1% tratados con placebo).
Acerca de AMITIZA
AMITIZA está indicado para el tratamiento del estreñimiento idiopático crónico de pacientes adultos. AMITIZA no debe utilizarse en pacientes con hipersensibilidad a alguno de los componentes de esta formulación y en pacientes con un historial de mecanismos de obstrucción mecánica gastrointestinal. Los pacientes con síntomas que indiquen que padecen obstrucción mecánica gastrointestinal deberán ser evaluados antes de comenzar el tratamiento con AMITIZA.
La seguridad de AMITIZA en el embarazo no ha sido evaluada en seres humanos. En cobayas, lubiprostone ha demostrado tener el potencial necesario para causar la pérdida fetal. AMITIZA deberá utilizarse durante el embarazo sólo si los beneficios justifican el riesgo potencial para el feto. Las mujeres que vayan a quedarse embarazadas deberán dar negativo en las pruebas de embarazo antes de comenzar la terapia con AMITIZA y deberán poder cumplir con eficaces medidas anticonceptivas.
AMITIZA no deberá administrarse a pacientes que padezcan diarrea severa. Los pacientes deberán estar al corriente de los posibles casos de diarrea que pueden producirse durante el tratamiento. Si la diarrea se vuelve severa, los pacientes deberán ponerse en contacto con su médico.
En ensayos clínicos los efectos adversos más comunes fueron las náuseas (31%). Otros efectos secundarios (mayor o igual al 5% de los pacientes) incluyeron la diarrea (13%), dolores de cabeza (13%), distensión abdominal (7%), dolor abdominal (7%), flatulencias (6%), sinusitis (5%) y vómitos (5%).
Si desea conocer la prescripción completa visite http://www.amitiza.com.
Sucampo Pharmaceuticals, Inc.
Sucampo Pharmaceuticals Inc. es una compañía farmacéutica emergente con sede en Bethesda, Md. Sucampo fue fundada en 1996 por Sachiko Kuno, doctor, el director general y consejero delegado de la compañía, y Ryuji Ueno, doctor, cofundador de la compañía y responsable científico. Sucampo se centra en la investigación y comercialización de medicamentos basados en prostones, una clase de compuestos derivados de los ácidos grasos funcionales que se forman en el cuerpo humano. El potencial terapéutico de los prostones fue identificado por el doctor Ueno. En enero de 2006, Sucampo recibió la aprobación de marketing de la FDA para su primer producto, AMITIZA, para el tratamiento del estreñimiento idiopático crónico en adultos. Sucampo tiene un acuerdo con Takeda Pharmaceutical Company Limited (Osaka, Japón) para comercializar de forma conjunta AMITIZA en EE.UU. y Canadá para indicaciones gastrointestinales. El personal de ventas especializado de Sucampo complementa los esfuerzos de Takeda de centrarse en servicios de atención médica institucionales y a largo plazo.
AMITIZA(TM) es una marca registrada de Sucampo Pharmaceuticals, Inc.
Prucaloprida
|
| DESCRIPCION La prucaloprida es un agonista selectivo de alta afinidad del receptor de serotonina (5-HT4), lo cual puede explicar sus efectos procinéticos. Se utiliza en el tratamiento sintomático del estreñimiento crónico en mujeres en las cuales los laxantes usuales no proporcionan un alivio adecuado. Mecanismo de acción: La prucaloprida es una dihidrobezofurancarboxamida con actividades procinéticas gastrointestinales. La prucaloprida es un agonista selectivo de alta afinidad del receptor de serotonina (5-HT4), lo cual puede explicar sus efectos procinéticos. In vitro, se ha detectado afinidad por otros receptores solo a concentraciones al menos 150 veces superiores a las concentraciones que exceden su afinidad por el receptor 5-HT4. En ratas, la prucaloprida administrada in vivo, a dosis superiores a 5 mg/kg (igual o superior a 30-70 veces la exposición clínica), indujo hiperprolactinemia causada por una acción antagonista a nivel del receptor D2. En perros, la prucaloprida altera los patrones de motilidad del colon a través de la estimulación del receptor de serotonina 5-HT4: estimula la motilidad colónica proximal, potencia la motilidad gastroduodenal y acelera el vaciado gástrico lento. Además, la prucaloprida induce contracciones peristálticas gigantes. Estas equivalen a movimientos de masa colónica en el humano y proporcionan la fuerza propulsora principal para la defecación. En perros, los efectos observados en el tracto digestivo son sensibles al bloqueo con antagonistas selectivos del receptor 5-HT4, poniendo de manifiesto que los efectos observados se ejercen por medio de la acción selectiva sobre los receptores 5-HT4 Farmacocinética: después de una dosis oral de 2 mg, la prucaloprida se absorbe rápidamente. Las concentraciones plasmáticas máximas se alcanzan en 2-3 horas. La biodisponibilidad oral absoluta es > 90%. La ingesta concomitante de alimentos no afecta a la biodisponibilidad de la prucaloprida. Con el tratamiento diario de 2 mg de prucaloprida, las concentraciones plasmaticas en estado estacionario fluctuan entre 2,5 ng/ml y 7 ng/ml. La farmacocinética de la prucaloprida es lineal dentro del rango de dosis de 1 a 20 mg. La prucaloprida se distribuye ampliamente, con un volumen de distribución una vez alcanzado el estado estacionario (Vdss) de 567 litros. La unión a proteínas plasmáticas de la prucaloprida es de aproximadamente un 30%. La mayor parte de la prucaloprida no se metaboliza. Después de la administración de prucaloprida marcada con 14C, el 85% de la radioactividad se recuperó en las heces. El metabolito principal , formado por O-desmetilación y oxidación de la función alcohólica resultante a un ácido carboxílico, supuso menos del 4% de la dosis. Una gran proporción del principio activo es excretado de forma inalterada (aproximadamente el 60% de la dosis administrada en orina y al menos el 6% en heces). El aclaramiento plasmático promedio de la prucaloprida es de 317 ml/min. Su semivida terminal es de aproximadamente un dia. El estado estacionario se alcanza a los 3-4 dias. Tras la administracion de una dosis unica diaria de 1 mg, las concentraciones plasmaticas pico y el AUC de la prucaloprida en sujetos de edad avanzada fueron un 26% y un 28% mas elevadas que en los adultos jovenes En comparacion con los sujetos que presentan una funcion renal normal, las concentraciones plasmaticas de la prucaloprida despues de una dosis unica de 2 mg fueron de media un 25% y un 51% mas elevadas en los sujetos con insuficiencia renal leve (aclaramiento de creatinina : 50-79 ml/min) y moderada (aclaramiento de creatinina 25-49 ml/min), respectivamente. En los sujetos con insuficiencia renal avanzada (aclaramiento de creatinina. 24 ml/min), las concentraciones plasmaticas fueron 2,3 veces superiores a las concentraciones en los sujetos sanos. | ||
| INDICACIONES Y POSOLOGIA Administración oral:
Pacientes con insuficiencia hepática: Los pacientes con insuficiencia hepática grave (Child-Pugh clase C) comienzan con 1 mg una vez al día que puede aumentarse a 2 mg en caso necesario para mejorar la eficacia y si se tolera bien la dosis de 1 mg-No se requiere ajuste de la dosis en pacientes con insuficiencia hepática leve a moderada. Debido al mecanismo de acción específico de la prucaloprida (estimulación de la motilidad propulsora), no se espera que dosis diarias superiores a 2 mg proporcionen una mayor eficacia. | ||
| CONTRAINDICACIONES Y PRECAUCIONES La prucaloprida está contraindicada en pacientes con hipersensibilidad al principio activo o a alguno de los componentes de su formulación (p. ej: lactosa) También está contraindicada en casos de perforación u obstrucción intestinal debida a un trastorno estructural o funcional de la pared intestinal, íleo obstructivo, y trastornos inflamatorios graves del tracto intestinal, como la enfermedad de Crohn, colitis ulcerosa y megarrecto/megacolon tóxico La prucaloprida se excreta principalmente por los riñones, por lo que se debe administrar con precaución en pacientes con insuficiencia renal avanzada. Esta totalmente contraindicada en la insuficiencia renal que requiere diálisis. Se debe tener precaución al prescribir prucaloprida a pacientes con insuficiencia hepática grave (Child-Pugh clase C) ya que los datos son limitados. No se ha establecido la seguridad y eficacia de la prucaloprida en pacientes con enfermedad concomitante grave o clínicamente inestable (por ej.: enfermedad cardiovascular o pulmonar, trastornos neurológicos o psiquiátricos, cáncer o SIDA y otros trastornos endocrinos. En particular en los pacientes con antecedentes de arritmias o enfermedad isquémica cardiovascular deben extremarse las precauciones. Otros procinéticos (pej. cisaprida) , producen un aumento del intervalo QT que puede derivar en arritmias ventriculares, que no puede descartarse en el caso de la prucaloprida aunque de momento no se han observado tales efectos l Se desconocen la seguridad y la eficacia de la prucaloprida en los varones. Por lo tanto, no se recomenda este fármaco en pacientes de sexo masculino. | ||
| La prucaloprida se clasifica dentro de la categoria C de riesgo en el embarazo. pLos estudios en animales no indican efectos perjudiciales directos ni indirectos con respecto al embarazo, el desarrollo embrionario/fetal, parto o desarrollo postnatal . Sin embargo, los hallazgos en los animales no siempre son predicitivos de lo que puede ocurrir en el hombre. En los ensayos clínicos realizados se han observado casos de aborto espontáneo, aunque se desconoce la relación de causalidad con la prucaloprida en presencia de otros factores de riesgo. No se recomienda la utilización de prucaloprida durante el embarazo. Las mujeres en edad fértil deben utilizar métodos anticonceptivos efectivos durante el tratamiento con prucaloprida. La prucaloprida se excreta en la leche materna. Al no disponer de datos en humanos, no se recomienda el uso de la prucaloprida durante la lactancia. | ||
| INTERACCIONES Debido a su escasa metabolización la prucaloprida no interacciona con las isoenzimas del citocromo P450 a las concentraciones clinicamente relevantes. Aunque la prucaloprida puede comportarse como un sustrato débil de la P-glicoproteína (P-gp), no es un inhibidor de la P-gp a concentraciones clínicamente relevantes. Durante la coadministración de prucaloprida, se encontró un aumento del 30% en las concentraciones plasmáticas de la eritromicina. El mecanismo de interacción no está dilucidado. La prucaloprida no tuvo efectos clínicamente relevantes en la farmacocinética de la warfarina, la digoxina, el alcohol, la paroxetina y anticonceptivos orales. El ketoconazol (200 mg 2 veces al día), un potente inhibidor de CYP3A4 y de P-gp, aumentó la exposición sistémica a la prucaloprida en aproximadamente un 40%. Este efecto es demasiado pequeño para ser clínicamente relevante. Pueden esperarse interacciones de magnitud similar con otros inhibidores potentes de la P-gp tales como el verapamilo, la ciclosporina A y la quinidina. | ||
| REACCIONES ADVERSASLas reacciones adversas producidas por la prucaloprida se han identificado a partir de los datos obtenidos en unos 2700 pacientes Las reacciones adversas notificadas con mayor frecuencia asociadas al tratamiento con prucaloprida son la cefalea y los sintomas gastrointestinales (dolor abdominal, nauseas o diarrea) ocurriendo cada una de ellas en aproximadamente un 20% de los pacientes. Las reacciones adversas ocurren principalmente al inicio del tratamiento y suelen desaparecer al cabo de pocos diascontinuando con el tratamiento. Las reacciones adversas se enumeran seguidamente por sistemas y frecuencias
Se notificaron palpitaciones en el 0,7% de los pacientes con placebo, en el 1,0% de los pacientes que recibieron 1 mg de prucaloprida, en el 0,7% en los pacientes que recibieron 2 mg de prucaloprida y en el 1,9% de los pacientes que recibieron 4 mg de prucaloprida. La mayoria de los pacientes continuo el tratamiento con prucaloprida. | ||
| PRESENTACION RESOLOR, comp 1 y 2 mg. SHIRE FARMACEUTICA IBERICA | ||
REFERENCIAS
|
Suscribirse a:
Entradas (Atom)