Achalasia is a primary esophageal motility disorder characterized by the absence of esophageal peristalsis and impaired relaxation of the lower esophageal sphincter (LES) in response to swallowing. The LES is hypertensive in about 50% of patients. These abnormalities cause a functional obstruction at the gastroesophageal junction (GEJ).
Signs and symptoms
Symptoms of achalasia include the following:
- Dysphagia (most common)
- Regurgitation
- Chest pain
- Heartburn
- Weight loss
Physical examination is noncontributory.
See Presentation for more detail.
Diagnosis
Laboratory studies are noncontributory. Studies that may be helpful include the following:
- Esophageal manometry (the criterion standard): Incomplete LES relaxation in response to swallowing, high resting LES pressure, absent esophageal peristalsis
- Prolonged esophageal pH monitoring to rule out gastroesophageal reflux disease and determine if abnormal reflux is being caused by treatment
- Esophagogastroduodenoscopy to rule out cancer of the GEJ or fundus
- Concomitant endoscopic ultrasonography if a tumor is suspected
See Workup for more detail.
Management
The goal of therapy for achalasia is to relieve symptoms by eliminating the outflow resistance caused by the hypertensive and nonrelaxing LES.
Pharmacologic and other nonsurgical treatments include the following:
- Administration of calcium channel blockers and nitrates decrease LES pressure (primarily in elderly patients who cannot undergo pneumatic dilatation or surgery)
- Endoscopic intrasphincteric injection of botulinum toxin to block acetylcholine release at the level of the LES (mainly in elderly patients who are poor candidates for dilatation or surgery)
Surgical treatment includes the following:
- Laparoscopic Heller myotomy, preferably with anterior (Dor; more common) or posterior (Toupet) partial fundoplication
- Peroral endoscopic myotomy (POEM)
Patients in whom surgery fails may be treated with an endoscopic dilatation first. If this fails, a second operation can be attempted once the cause of failure has been identified with imaging studies. Esophagectomy is the last resort.
See Treatment and Medication for more detail.Sir Thomas Willis described achalasia in 1672. In 1881, von Mikulicz described the disease as a cardiospasm to indicate that the symptoms were due to a functional problem rather than a mechanical one. In 1929, Hurt and Rake realized that the disease was caused by a failure of the lower esophageal sphincter (LES) to relax. They coined the term achalasia, meaning failure to relax.
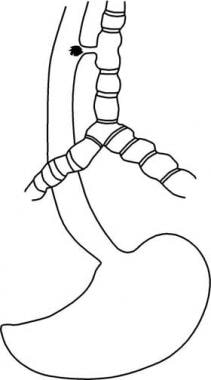
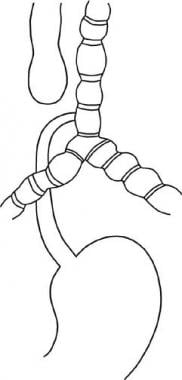
Achalasia is a primary esophageal motility disorder characterized by the absence of esophageal peristalsis and impaired LES relaxation in response to swallowing. The LES is hypertensive in about 50% of patients. These abnormalities cause a functional obstruction at the gastroesophageal junction. See the images below.
Pathophysiology
LES pressure and relaxation are regulated by excitatory (eg, acetylcholine, substance P) and inhibitory (eg, nitric oxide, vasoactive intestinal peptide) neurotransmitters. Persons with achalasia lack nonadrenergic, noncholinergic, inhibitory ganglion cells, causing an imbalance in excitatory and inhibitory neurotransmission.[1] The result is a hypertensive nonrelaxed esophageal sphincter.
Etiology
There is some evidence that achalasia is an autoimmune disease.[1, 2, 3] A European study compared immune-related deoxyribonucleic acid (DNA) in persons with achalasia with that of controls and found 33 single-nucleotide polymorphisms (SNPs) associated with achalasia. All of the were found in the major histocompatability complex region of chromosome 6, a location associated with autoimmune disorders such as multiple sclerosis, lupus, and type 1 diabetes.[2, 3]
Epidemiology
United States incidence
The incidence of achalasia is approximately 1 per 100,000 people per year.
The incidence of esophageal dysmotility appears to increased in patients with spinal cord injury (SCI).[4] In a study of 12 patients with paraplegia (level of injury between T4-T12), 13 patients with tetraplegia (level of injury between C5-C7), and 14 able-bodied individuals, Radulovic et al found 21 of the 25 patients (84%) with SCI had at least one esophageal motility anomaly compared to 1 of 14 able-bodied subjects (7%). Among the anomalies seen in SCI patients were type II achalasia (12%), type III achalasia (4%), esophagogastric junction outflow obstruction (20%), hypercontractile esophagus (4%), and peristaltic abnormalities (weak peristalsis with small or large defects or frequent failed peristalsis) (48%}.[4]
Altered esophageal motility is sometimes seen in patients with anorexia nervosa.[5] It is also seen in patients following eradication of esophageal varices by endoscopic sclerotherapy, in association with an increased number of endoscopic sessions but not with manometric parameters.[6] Features of esophageal motility after endoscopic sclerotherapy are a defective lower sphincter and defective and hypotensive peristalsis.
International data
In a retrospective study (1990-2013) from the Netherlands, the mean incidence of achalasia in children was 0.1 per 100,000 people per year .[7] Relapse rates after the initial treatment were higher in those who underwent pneumodilation (79%) than Heller myotomy (21%), but complication were occurred more often following Heller myotomy (55.6%) than with pneumodilation (1.5%).
Chagas disease may cause a similar disorder to achalasia.
Sex- and age-related demographics
The male-to-female ratio of achalasia is 1:1.
Achalasia typically occurs in adults aged 25-60 years. Less than 5% of cases occur in children.
History and Physical Examination
Achalasia is characterized by the following symptoms and signs[8] :
- Dysphagia (most common)
- Regurgitation
- Chest pain
- Heartburn
- Weight loss
The physical examination is noncontributory
Diagnostic ConsiderationsCancer of the gastroesophageal junctionEsophageal perforation
The invasion of the esophageal neural plexus by the tumor can cause nonrelaxation of the LES, thus mimicking achalasia. This condition is known as malignant pseudoachalasia. Since contrast radiography and endoscopy frequently fail to differentiate these 2 entities, patients with a presumed diagnosis of achalasia but who have a shorter duration of symptoms, greater weight loss, and a more advanced age and who are referred for minimally invasive surgery should undergo additional imaging studies, including endoscopic ultrasound and computed tomography with fine cuts of the gastroesophageal junction, to rule out cancer.
Pneumatic dilatation for achalasia carries a significant and recognized risk of esophageal perforation. Therefore, an informed consent emphasizing this risk of perforation must be obtained from patients prior to the dilatation.
After the dilatation, administer a small amount of water-soluble contrast material to evaluate for perforation. This should be performed in all patients undergoing the procedure. If no perforation is noted, the patient's diet can be advanced slowly after a period of observation.
Patients with a small perforation without any evidence of infection or communication with the pleural or peritoneal cavities may receive conservative therapy with broad-spectrum antibiotics and close observation in the hospital.
A surgical consultation must be obtained as soon as a perforation is identified. Any clinical deterioration or communication with the mediastinum or pleural or peritoneal cavities necessitates surgical intervention..
Approach Considerations
A diagnosis of achalasia should be considered when patients present with dysphagia, chest pain, and refractory reflux symptoms after an endoscopy does not reveal a mechanical obstruction or an inflammatory cause of esophageal symptoms.[9]
The American College of Gastroenterology released new guidelines for the diagnosis and management of achalasia in July 2013.[10, 11] Recommendations for the proper diagnosis of the disorder include the following:
- Performing an esophageal motility test on all patients suspected of having achalasia
- Using esophagram findings to support a diagnosis
- Using barium esophagram, as recommended for patients with equivocal motility testing
- Endoscopic assessment of the gastroesophageal junction and gastric cardia, as recommended, to rule out pseudoachalasia
Laboratory studies are generally noncontributory.
Esophageal pressure topography (EPT) may be the preferred assessment modality of esophageal motility over conventional line tracings (CLT).[12] Six attending gastroenterologists and six gastroenterology fellows from 3 academic centers interpreted each of the 40 studies using both EPT and CLT formats: Among all raters, the odds of an incorrect exact esophageal motility diagnosis were 3.3 times higher with CLT than with EPT, and the odds of incorrect identification of a major motility disorder were 3.4 times higher with CLT than with EPT.
Imaging Studies
Barium swallow
The esophagus appears dilated, and contrast material passes slowly into the stomach as the LES opens intermittently. The distal esophagus is narrowed and has been described as resembling a bird's beak (see the image below).
Other Tests
Esophageal manometry (see the image below) is the criterion standard in helping to diagnose the classic findings of achalasia.[13] These findings include the following:
- Incomplete relaxation of the LES in response to swallowing
- High resting LES pressure
- Absent esophageal peristalsis
Prolonged esophageal pH monitoring is important for the following reasons:
- To rule out gastroesophageal reflux disease (GERD)
Procedures
Perform an esophagogastroduodenoscopy (EGD) to rule out cancer of the gastroesophageal junction or fundus. If a tumor is suspected, perform an endoscopic ultrasound at the same time.The American College of Gastroenterology released new guidelines for the diagnosis and management of achalasia in July 2013.[10, 11] Treatment recommendations are as follows:
- Initial therapy should be either graded pneumatic dilation (PD) or laparoscopic surgical myotomy with a partial fundoplication in patients fit to undergo surgery
- Procedures should be performed in high-volume centers of excellence
- Initial therapy choice should be based on patient age, sex, preference, and local institutional expertise
- Botulinum toxin therapy is recommended for patients not suited to PD or surgery
- Pharmacologic therapy can be used for patients not undergoing PD or myotomy and who have failed botulinum toxin therapy (nitrates and calcium channel blockers most common)
Medical Care
The goal of therapy for achalasia is to relieve symptoms by eliminating the outflow resistance caused by the hypertensive and nonrelaxing LES. Once the obstruction is relieved, the food bolus can travel through the aperistaltic body of the esophagus by gravity.Calcium channel blockers and nitrates are used to decrease LES pressure. Approximately 10% of patients benefit from this treatment. This treatment is used primarily in elderly patients who have contraindications to either pneumatic dilatation or surgery.Endoscopic treatment includes an intrasphincteric injection of botulinum toxin to block the release of acetylcholine at the level of the LES, thereby restoring the balance between excitatory and inhibitory neurotransmitters.[15] This treatment has limited value. Only 30% of patients treated endoscopically still have relief of dysphagia 1 year after treatment. Most patients need repeated botulinum toxin injections, with short-lasting clinical benefits. This treatment can cause an inflammatory reaction at the level of the gastroesophageal junction, making a subsequent myotomy very difficult. Compared with pneumatic dilation, botulinum toxin injection is associated with significantly higher symptom recurrence rates at 12 months.[16] Similarly, this treatment modality is less effective than laparoscopic Heller myotomy at 2-year follow-up.[17] Use this treatment in elderly patients who are poor candidates for dilatation or surgery.Pneumatic dilatation performed by a qualified gastroenterologist is the recommended treatment in those sporadic cases in which surgery is not appropriate.[18] A balloon is inflated at the level of the gastroesophageal junction to blindly rupture the muscle fibers while leaving the mucosa intact. The success rate is 70-80%, and the perforation rate is approximately 5%. If a perforation occurs, emergency surgery is needed to close the perforation and to perform a myotomy. As many as 50% of patients may require more than 1 dilatation. The incidence of pathologic gastroesophageal reflux after the procedure is approximately 30%.A laparoscopic Heller myotomy is considered by many to be the appropriate primary treatment of patients with achalasia (see Surgical Care). A Heller myotomy and a partial fundoplication performed from the chest (thoracoscopic) have a high incidence of gastroesophageal reflux.[19]Peroral endoscopic myotomy (POEM) has been introduced relatively recently as a novel approach to achalasia.[20, 21] This procedure is performed under general anesthesia with endotracheal intubation. A 2-cm longitudinal mucosal incision is made on the mucosal surface to create a mucosal entry to the submucosal space. An anterior submucosal tunnel is created downwards, passing the gastroesophageal junction and about 3 cm into the proximal stomach. Once the submucosal tunnel is completed, section of the circular muscle fibers begins 2-3 cm distal to the mucosal entry, approximately 7 cm above the gastroesophageal junction. The myotomy is continued step by step distally until the gastric submucosa is reached, extending approximately 2-3 cm distal to the gastroesophageal junction. After identification and section of the circular muscle fibers of the lower esophagus and proximal stomach, the mucosal entry site is closed with hemostatic clips.Several potential advantages of POEM compared with laparoscopic Heller myotomy have been proposed. The endoscopic approach should theoretically minimize postoperative pain. A longer myotomy can be performed, extending to the medium third of the esophagus, just below the aortic arch. A concomitant antireflux surgery may not be required because of the selective section of the circular muscle fibers without any dissection at the level of the gastroesophageal junction. In current practice, few data are available regarding clinical outcomes in small series of patients over very short follow-up periods.In a comparative study that evaluated the symptomatic and objective outcomes of of laparoscopic Heller myotomy with POEM for achalasia, Bhayani et al reported a shorter hospitalization in those who underwent POEM than those who underwent myotomy, but both procedures showed equivalent improvement in symptoms and esophageal physiology as well as equivalent postoperative esophageal acid exposure.[22] Worrell et al reported similar findings.[23]Based on the limited evidence available, POEM seems to be a promising procedure. However, there are some concerns about this technique. Endoscopic myotomy is a very demanding procedure, requiring major skills, with a very long learning curve. Even though several studies have reported significant reduction of LES pressure as demonstrated by manometry, the LES pressure was often between 15 and 20 mm Hg. It is known that a predictor of long-term success is an LES pressure around 10 mm Hg.[24] Gastroesophageal reflux is reported in up to 50% of patients after POEM, replicating the results obtained when a myotomy alone was performed without an antireflux operation. Surgical revision in patients with recurrent dysphagia after POEM might be challenging. The presence of adhesions between the submucosal and longitudinal muscular layers after POEM might make the dissection at this level very difficult.Surgical Care
Because of excellent results, a short hospital stay, and a fast recovery time, the primary treatment is considered by many to be a laparoscopic Heller myotomy and partial fundoplication. In the author's experience and in the experience of many authors, this treatment provides a fine balance in relieving symptoms of dysphagia by performing the myotomy and in preventing gastroesophageal reflux by adding a partial wrap.[25, 26] A prospective, randomized study from Vanderbilt University indicated that there is significantly less risk of postoperative reflux following a Heller myotomy plus a partial fundoplication than there is after a Heller myotomy alone.[27] The authors of this study also showed that in patients with achalasia, adding a partial fundoplication not only is more effective in preventing postoperative reflux but also is more cost-effective at a time horizon of 10 years.[28]A partial fundoplication added to the myotomy entails better functional results when compared with a total fundoplication, with a lower risk of persistent or recurrent dysphagia.[29] Recently, a multicenter, randomized controlled trial comparing partial anterior (Dor) with partial posterior (Toupet) fundoplication did not find significant differences in terms of postoperative incidence of gastroesophageal reflux.[30] In current practice, a partial anterior fundoplication is more frequently performed since it is simpler to perform and covers the exposed esophageal mucosa.[31]In the European Achalasia Trial, treatment with pneumatic dilation or laparoscopic Heller myotomy was successful in a higher percentage of patients with type II achalasia than in patients with the type I or III form of the disease. Although success rates were high for both approaches in type II achalasia, the success rate was significantly higher in the group treated with pneumatic dilation.[32] However, relapse is common after pneumatic dilation. For good long-term outcomes, close follow-up and repeat dilation are required.[33]Minimally invasive surgery for achalasia is performed under general anesthesia with the use of 5 trocars. A controlled division of the muscle fibers (myotomy) of the lower esophagus (5 cm) and the proximal stomach (1.5 cm) is carried out, followed by a partial fundoplication to prevent reflux. See the images below.Patients remain hospitalized for 24-48 hours and return to regular activities in about 2 weeks.The operation relieves symptoms in 85-95% of patients, and the incidence of postoperative reflux is about 20%.For patients in whom surgery fails, they may be treated with an endoscopic dilatation first. If this fails, a second operation (extending the previous myotomy onto the anterior gastric wall) can be attempted once the cause of failure has been identified with imaging studies. The last resort is to surgically remove the esophagus (ie, esophagectomy).Treatment options vary for patients with different degrees of illness severity. A study by Reynoso et al suggests that among hospitalized patients with minor/moderate illness severity, laparoscopic myotomy for achalasia showed comparable or better outcomes than esophageal dilation.[34] For major/extreme illness severity, dilation showed a comparable or better profile for hospitalized patients with achalasia.Esophagectomy was the standard treatment in patients with achalasia and a markedly dilated or sigmoid-shaped esophagus, with Heller myotomy considered to be ineffective in such cases. However, in a study by Sweet and colleagues of 113 patients with achalasia, the investigators reported that (1) in most of the study's patients, even those with achalasia and a dilated esophagus, a laparoscopic Heller myotomy relieved dysphagia; (2) additional treatment was needed in about 20% of patients; and (3) in the end, 90% of patients had attained good swallowing ability. Esophagectomy was not required in any of the patients to maintain clinically adequate swallowing.[35]Cowgill et al reported on outcomes in 47 patients more than 10 years after laparoscopic Heller myotomy for achalasia.[36] They found that notable complications were infrequent following the procedure and that no perioperative deaths had occurred. One patient underwent a second myotomy 5 years after the first, because of symptom recurrence. There were 33 surviving patients at the time of the study; the authors reported that the other patients died from causes unrelated to myotomy. Using a Likert scale and a Wilcoxon matched-pairs test to assess patients’ symptoms before and after laparoscopic myotomy, Cowgill et al found significant postsurgery decreases in the frequency and severity scores for dysphagia, chest pain, vomiting, regurgitation, choking, and heartburn. They concluded that "the symptoms of achalasia are durably ameliorated by laparoscopic Heller myotomy during long-term follow-up evaluation."Compared with pneumatic dilatation, laparoscopic Heller myotomy is associated with better results in terms of dysphagia improvement and postoperative gastroesophageal reflux rates, with a significantly lower risk of re-intervention.[37]Although the results are similar at a short-term follow-up,[38] long-term follow-up shows that most patients after surgery are asymptomatic, compared with only 50% of patients even after multiple pneumatic dilatations.[39]Several studies have shown better outcomes after laparoscopic Heller myotomy than pneumatic dilatation in patients younger than 40 years.[38] In addition, previous endoscopic treatment, such as botulinum toxin injection or pneumatic dilatation, may compromise the clinical outcome of laparoscopic Heller myotomy. Higher intraoperative complications rates and poorer long-term outcomes after laparoscopic Heller myotomy have been reported in several series of patients previously treated with endoscopic treatments. These findings may be related to scar tissue at the level of the gastroesophageal junction, which makes surgical dissection of the anatomic planes much more difficult.[40, 41]In 2011, Boeckxstaens et al[38] reported the results of a multicenter, randomized trial comparing pneumatic dilatation (95 patients) to laparoscopic Heller myotomy with Dor fundoplication (106 patients) for untreated esophageal achalasia. The perforation rate during pneumatic dilatation and laparoscopic Heller myotomy was 4% and 12%, respectively. Therapeutic success was defined as a drop in Eckardt score below 3. The study showed similar success rates after laparoscopic Heller myotomy (90%) and pneumatic dilatation (86%) over a 2-year follow-up period.In conclusion, while pneumatic dilatation was considered the main treatment modality for patients with achalasia in the 1980s, with surgery having a secondary role in case of dilatation failure,[42, 43] in current practice pneumatic dilatation should be reserved for when surgical expertise is not available and for the treatment of recurrent dysphagia after myotomy.One study only has compared in a retrospective fashion POEM and laparoscopic Heller myotomy.[44] Eighteen patients undergoing POEM were compared in a nonrandomized fashion to 55 patients treated by laparoscopic Heller myotomy. No differences were observed in terms of length of the myotomy, complication rate, and length of hospital stay. Veress needle decompression of the pneumoperitoneum was required intraoperatively in 7 (39%) patients undergoing POEM. Treatment success (Eckardt score ≤3) after POEM was achieved in 16 (89%) patients at median 6-month follow-up. Six weeks after POEM, routine follow-up manometry and timed-esophagram showed normalization of esophagogastric junction pressures and contrast column heights.Only long-term follow-up and prospective trials comparing POEM with laparoscopic Heller myotomy and fundoplication will determine the role of this new technique in the treatment of esophageal achalasia.Calcium channel blockers and nitrates both decrease LES pressure but do not improve LES relaxation. Approximately 10% of patients benefit from medical treatment, which should be used primarily in elderly patients who have contraindications to either pneumatic dilatation or surgery or as a temporary measure while other treatments are considered.[45]These agents interfere with calcium uptake by smooth muscle cells that are dependent on intracellular calcium for contraction. They have a relaxant effect on the LES muscle.Nifedipine (Adalat)
Inhibits transmembrane influx of calcium ions into smooth muscle, which, in turn, inhibits contraction of the muscle fibers.Nitrates
Has a relaxant effect on smooth muscle fibers of LES. Relaxes vascular smooth muscle by stimulating intracellular cyclic GMP.N